DOI: http://dx.doi.org/10.19137/cienvet202224107
![]() Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, lhttp://www.creativecommons.org.ar/licencias.html
Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, lhttp://www.creativecommons.org.ar/licencias.html
COMUNICACIONES CORTAS
Patrón doppler espectral diferencial para el
tracto de salida del ventrículo derecho
Differential spectral doppler pattern for the right
ventricular outflow tract
Padrão diferencial de doppler espectral para o
trato de saída do ventrículo direito
Meder AR, Sereno DP, Sosa E
Cátedra de Patología Médica. Facultad de Ciencias Veterinarias. UNLPam. Calle 116 esq. 5 s/n. CP 6360
Correo electrónico: ameder@vet.unlpam.edu.ar
Resumen La exploración doppler espectral del tracto de salida ventricular
derecho (TSVD) brinda información hemodinámica para el diagnóstico
diferencial de cardiopatías. El perfil del flujo aporta datos de velocidad
punta, tiempo, dirección y determinación anatómica o funcional
de distintas alteraciones. El objetivo del presente trabajo es analizar el
patrón doppler espectral del TSVD para contribuir al diagnóstico diferencial
de cardiopatías y trastornos hemodinámicos en animales de
compañía. El trazado espectral eyectivo normal muestra perfil simétrico,
punta redondeada y velocidad punta inferior a 1.81 m/s (Tipo
I). La hipertensión pulmonar, a consecuencia del aumento de la resistencia
vascular pulmonar, puede presentar perfil de daga, asimétrico
y velocidad punta que se alcanza dentro del primer tercio del trazado
(Tipo II). La presencia de melladura en el tercio final de la curva
de desaceleración define al perfil como de Tipo III. En los procesos
estenóticos la velocidad punta e integral velocidad tiempo, superan
el rango normal y permiten determinar la gravedad. La estenosis fija pulmonar presenta perfil simétrico y alta velocidad (> a 1.81 m/s). En
obstrucciones dinámicas, el perfil es invertido, alcanzándose la velocidad
máxima al final de la curva de aceleración. En la persistencia del
conducto arterioso persistente, el perfil es continuo. Se observan flujos
positivos y negativos, sistodiastólicos, a lo largo de todo el trazado.
Los hallazgos de exploración doppler espectral, mediante el análisis
del perfil de flujo del TSVD, permiten diferenciar procesos patológicos
cardíacos, así como determinar su gravedad, colaborando de una manera
rápida en el diagnóstico diferencial.
Palabras clave: ecocardiografía, doppler, arteria pulmonar, trazado
espectral
Abstract Spectral doppler scanning of the right ventricular outflow tract
(RVOT) provides hemodynamic information for the differential diagnosis
of heart disease. The flow profile provides data of speed, time,
direction and anatomical or functional determination of different
changes. The objective of this present work is to analyze the spectral
doppler pattern of the right ventricular outflow tract to contribute to
the differential diagnosis of heart disease and hemodynamic disorders
in pets. The normal ejection spectral trace shows a symmetrical profile,
a rounded tip, and tip velocity less than 1.81 m / s (Type I). Pulmonary
hypertension, as a consequence of the increased pulmonary vascular
resistance, may present a dagger profile, asymmetric, and top speed
that is reached within the first third of the spectral trace (Type II). The
presence of a gap in the final third of the deceleration curve (flying W),
defines the profile as Type III. In stenotic processes top and integral
speed time, exceed the normal range and allow to classify the severity
of the process. Fixed pulmonary stenosis presents a symmetrical and
high-speed profile (> 1.81 m / s). In dynamic obstructions the spectral
profile is inverted, reaching the maximum speed at the end of the acceleration
curve. When ductus arteriosus is persistent, the flow profile
is continuous. Systodiastolic, positive and negative flows, are observed
throughout the entire trace. The findings of the spectral doppler scan
by means of the analysis of the flow profile of the right ventricular
outflow tract, allow to differentiate pathological processes present, as
well as determinate its severity, collaborating in a quick way in the
doppler differential diagnosis.
Key works: echocardiography, doppler, pulmonary artery, spectral
tracing
Resumo A análise espectral Doppler do trato de saída ventricular direita
(TSVD) fornece informações hemodinâmicas para o diagnóstico diferencial
de cardiopatias. O perfil do fluxo proporciona dados de velocidade
máxima, tempo, direção e determinação anatômica ou funcional
de diferentes alterações. O objetivo deste trabalho é analisar o padrão
espectral doppler do TSVD para contribuir ao diagnóstico diferencial
de doenças cardíacas e distúrbios hemodinâmicos em animais domésticos.
O caminho espectral ejetivo normal mostra perfil simétrico,
ponta arredondada e velocidade máxima inferior a 1,81 m/s (Tipo I).
A hipertensão pulmonar, como consequência do aumento da resistência
vascular pulmonar, pode apresentar perfil de punhal, assimétrico
e velocidade máxima alcançada dentro do primeiro terço do caminho
(Tipo II). A presença de falha no terço final da curva de desaceleração
define o perfil como Tipo III. Nos processos estenótipos a velocidade
máxima e o tempo de velocidade integral, superam a faixa normal
e permitem determinar a gravidade. A estenose pulmonar fixa apresenta
perfil simétrico e alta velocidade (> a 1,81 m/s). Em obstruções
dinâmicas, o perfil é invertido, atingindo a velocidade máxima no final
da curva de aceleração. Na persistência do canal arterial, o perfil é contínuo.
Fluxos sistodiastólicos positivos e negativos são observados ao
longo de todo o caminho. Os achados de exploração doppler espectral,
mediante a análise do perfil de fluxo do TSVD, permitem diferenciar
processos patológicos cardíacos, bem como determinar sua gravidade,
colaborando de forma rápida no diagnóstico diferencial.
Palavras-chave: ecocardiografia, doppler, artéria pulmonar, caminho
espectral
Las patologías cardíacas en caninos y felinos domésticos presentan una prevalencia superior al 10% en la población general (1- 7) El diagnóstico clínico, basado en la aproximación física al paciente, aporta datos sustanciales para diferenciar entre las distintas cardiopatías (8). La auscultación permite identificar el foco valvular, determinar el carácter regurgitativo o eyectivo del soplo cardíaco, su dirección, propagación,intensidad y tiempo dentro del ciclo cardíaco (9). Los estudios complementarios ayudan al diagnóstico definitivo de la anormalidad congénita o adquirida, aunque en muchas situaciones los exámenes de rutina (electrocardiografía, radiología simple, ecocardiografía Modos B y M) no son suficientes para interpretar las alteraciones hemodinámicas (10) . La ecocardiografía doppler aporta la información restante y es suficiente para determinar gravedad, implicancia hemodinámica, presiones camerales y en grandes vasos, establecer el diagnóstico definitivo de la patología e instaurar la terapia médica o quirúrgica necesaria (11). La valoración espectral del flujo sanguíneo del tracto de salida del ventrículo derecho (TSVD) representa un verdadero desafío, tanto en su técnica como en la valoración del compromiso cardíaco y su asociación hemodinámica con el parénquima pulmonar (12,13). El objetivo del presente trabajo es analizar el patrón doppler espectral del TSVD para contribuir al diagnóstico diferencial de las cardiopatías y trastornos hemodinámicos en caninos y felinos domésticos.
El doppler ha aumentado significativamente las capacidades diagnósticas de la ecografía cardíaca. Su capacidad para proporcionar información sobre dirección, velocidad, carácter, tiempo y gradiente de presión permite diagnósticos definitivos (14). El análisis doppler espectral del TSVD se puede realizar a partir de proyecciones ecocardiográficas estándar: 1) ventana paraesternal derecha eje corto nivel base cardiaca para la arteria pulmonar (Imagen 1), 2) ventana paraesternal derecha proyección del ventrículo izquierdo con la arteria pulmonar (Imagen 2, 3) ventana paraesternal izquierda transversa craneal de la base del corazón (Imagen 3) (15, 16) . Cada proyección presenta ventajas y limitaciones, las cuales pueden variar en relación a la especie (raza y conformación torácica), clasificación y gravedad de la cardiopatía, posición del paciente (decúbito, estación, otras) y habilidad del operador (17, 18). Deben analizarse múltiples proyecciones ya que los planos para una mejor alineación doppler varían de animal a animal (19. La vista utilizada deberá permitir la mejor alineación de la ventana y el cursor doppler sobre el TSVD (10) del paciente en estudio.
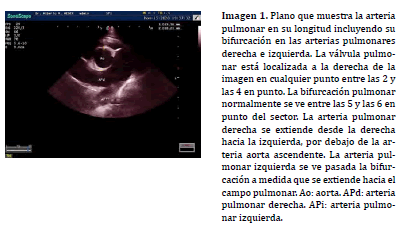
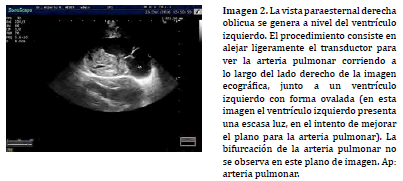
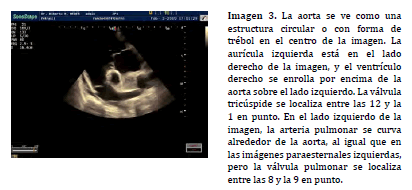
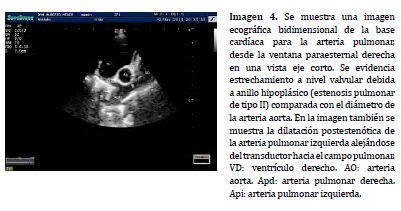
La alineación doppler espectral en el TSVD se puede realizar a nivel subvalvular, valvular y supravalvular, pudiendo variar la posición en relación a los hallazgos observados en la exploración bidimensional (Imagen 4) o asistida por doppler color (20) . En asociación a los procesos de estenosis e insuficiencia pulmonar, el mapa de flujo de color colabora en la determinación de la región ha posicionar la caja doppler y ayuda a identificar, mediante la señal de aliasing, el sitio exacto donde se presenta la mayor velocidad sobre el TSVD (Imagen 5).
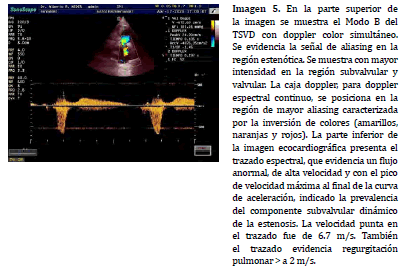
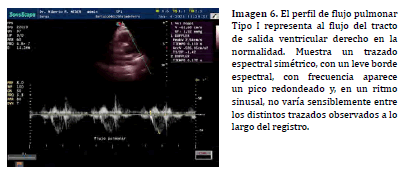
El flujo eyectivo normal del TSVD se caracteriza por un perfil espectral simétrico, la velocidad punta se presenta a la mitad, siendo el período/curva de aceleración, en forma temporal, idéntico al período/curva de desaceleración (Imagen 6). El espectro muestra una región central anecogénica/ hundida y un borde espectral ecogénico de grosor variable, generalmente uniforme, pero escaso (21,22). El borde espectral es el relleno de la típica forma de onda hundida. La velocidad máxima observada, normalmente, sobre el tracto de salida se establece en 1.30 m/s (8) aunque varios autores proponen el límite superior o máximo de 1.81 m/s (15) . La velocidad punta puede variar debajo del valor máximo o mantenerse constante en todo el trazado espectral (23-26,16).
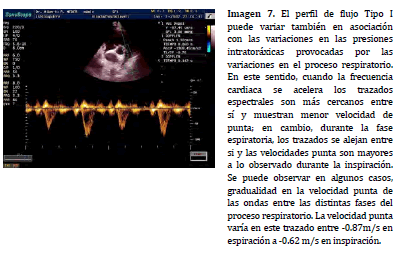
Las variaciones debajo del valor máximo normal se relacionan a la incidencia, sobre el llenado cardíaco, del ciclo respiratorio con espectros de mayor velocidad punta relacionados a la fase espiratoria y espectros de velocidad punta más reducida relacionados a la fase inspiratoria. Las modificaciones de la presión intratoráxica, que se acompañan de variaciones en el llenado ventricular derecho, son las responsables de las modificaciones descriptas (Imagen 7).
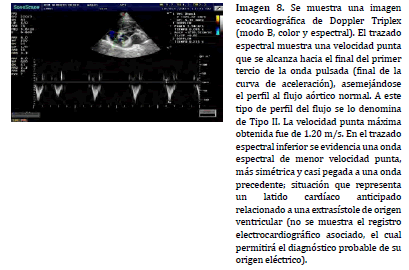
A frecuencias cardíacas aceleradas (< 2.5 veces la frecuencia cardíaca en reposo del paciente), con llenado constante de la cavidad ventricular derecha, el flujo muestra mayor velocidad punta y el perfil del espectro varía su conformación hacia un trazado asimétrico, similar (aunque con menor pendiente en la curva de aceleración) al perfil del espectro normal del tracto de salida del ventrículo izquierdo (Imagen 8). Este perfil pulmonar modificado se denomina de Tipo II (27). Esta situación se puede presentar sin la necesidad de que coexista hipertensión pulmonar asociada (aunque es más frecuente en presencia de la misma), y se relaciona al aumento de la frecuencia y contractilidad cardíaca y a la resistencia arterial pulmonar, en menor medida, generados por los niveles incrementados de catecolaminas (23)
Los perfiles del flujo pulmonar cambian a medida que se desarrolla hipertensión
pulmonar. (21, 28, 31)
Los signos doppler indirectos de hipertensión pulmonar incluyen varias
modificaciones posibles de la envoltura de la curva del flujo pulmonar.
(11) Todos los perros con hipertensión pulmonar muestran una aceleración
rápida del flujo sistólico en la arteria pulmonar, evidenciando perfiles espectrales
de Tipo II (32,13) (Imagen 9. A). Esta situación se debe al aumento
secundario de presión sistólica del ventrículo derecho en el inicio de la
eyección ventricular. Sin embargo, este tipo de espectro puede encontrarse
en perros sanos (33,15, 34,35). En algunas situaciones, sobre la curva de desaceleración,
se presenta una melladura o división de la onda espectral a
la mitad de la misma (Imagen 9. B). A esta melladura se la denomina vulgarmente
como martillo pulmonar y al perfil del flujo se lo denomina de
Tipo III (36, 13). La “muesca”, resultante del cierre parcial de las cúspides
de la válvula pulmonar durante la sístole, también se puede observar en la
envoltura espectral del flujo pulmonar en situación hipertensiva. Sin embargo,
la ausencia de este corte no excluye la hipertensión pulmonar (28,11).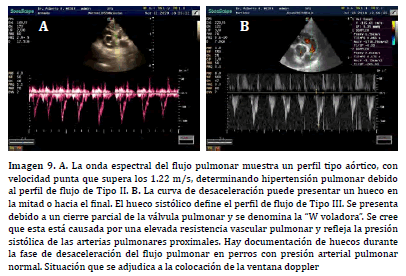
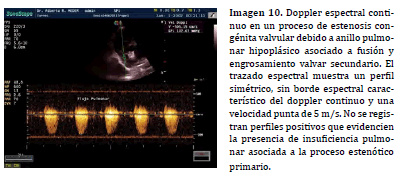
Los procesos obstructivos generados por anomalías congénitas que producen estenosis del TSVD muestran dos tipos de perfiles de flujo espectral pulmonar (25,37). En los procesos en los cuales la estenosis se presenta a nivel del anillo pulmonar (afectando el tamaño anular y/o produciendo fusión de comisuras valvares) o de la región supravalvular (entre la válvula pulmonar y la división de la arteria pulmonar en sus tributarias derecha e izquierda) el perfil del trazado espectral se presenta simétrico y con velocidad punta mayor a 1.81 m/s (38, 39,40,15) . Los valores alcanzados mediante doppler espectral continuo son variables y relacionados al grado de estenosis (Imagen 10).
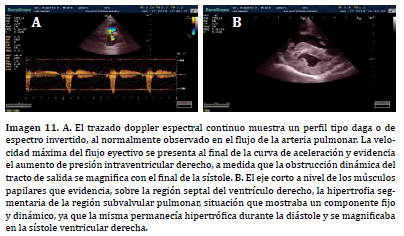
Por su parte, los procesos obstructivos de carácter dinámico (relacionados a estenosis subvalvular muscular), presentes sobre la región septal del TSVD promueven la formación de un perfil espectral invertido donde la velocidad punta se alcanza al final de la curva de aceleración (41,42). La fase de aceleración del espectro de flujo se desarrolla más lentamente que la fase de desaceleración, la cual muestra un ascenso brusco a la línea de base (Imagen 11. A). Los hallazgos ecográficos bidimensionales pueden identificar el proceso de obstrucción subvalvular (15, 11) y determinar, no sólo la región anatómica del ventrículo derecho afectada, sino si la naturaleza de la obstrucción muscular es fija, dinámica o tiene un comportamiento mixto (Imagen 11. B).
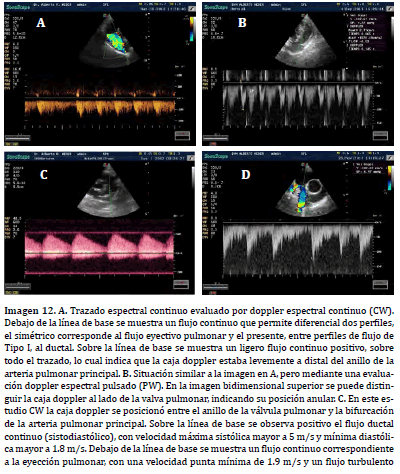
El patrón espectral continuo del trazado doppler sobre la arteria pulmonar
principal es característico de la presencia de conducto arterioso
persistente de izquierda a derecha, anomalía congénita caracterizada por
comunicación entre arteria aorta y arteria pulmonar (8). El trastorno hemodinámico
suma al espectro eyectivo normal, que se aleja del transductor, la
presencia de un espectro sistodiastólico anormal que puede tener carácter
positivo o negativo, en relación a la línea de base, dependiendo donde
se coloque la caja doppler en la valoración del TSVD (18, 15,11). Si la caja
doppler se sitúa sobre el anillo pulmonar a nivel valvular, se evidenciarán
dos espectros negativos, uno que se relaciona con el propio flujo pulmonar
eyectivo y de perfil Tipo I en fase sistólica, seguido por un perfil variable,
turbulento, sin borde espectral que muestra el movimiento desordenado
del flujo ductal dentro de la arteria pulmonar principal(10) (Imagen 12. A y
B). Si en cambio, la caja doppler se posiciona a mitad de camino entre el anillo pulmonar y la bifurcación de la arteria pulmonar principal, el perfil
del flujo será negativo para la fase sistólica y de eyección ventricular derecha
y se dispondrá positivo y continuo (sistodiastólico) para el movimiento
de sangre hacia el anillo pulmonar del flujo proveniente del ductus (15) (Imagen 12. C). Si la caja doppler se posiciona en la arteria pulmonar izquierda,
la cual permite una mejor alineación del cursor doppler continuo,
la proyección de los flujos sanguíneos (normal sistólico y proveniente de
la eyección ventricular derecha y anormal sistodiastólico, como resultado
de la proyección del flujo ductal) irradiará hacia la misma, permitiendo la
observación del trazado espectral continuo (Imagen 12. D).

La evaluación ecocardiográfica por doppler espectral aporta información hemodinámica significativa para valorar los flujos transvalvares. La valoración de la velocidad punta e integral velocidad tiempo son importantes en los procesos estenóticos, ya que aportan datos sobre gravedad del proceso e indicación de tratamiento. El análisis del perfil del trazado espectral pulsado o continuo, por su parte, muestra la variabilidad suficiente como para identificar los procesos hemodinámicos normales y patológicos presentes sobre el tracto de salida del ventrículo derecho. Su valoración es rápida, visual y el reconocimiento de los distintos espectros, facilita el diagnóstico ecocardiográfico en la rutina diaria. En este sentido, familiarizarse con los distintos trazados espectrales aporta una herramienta diagnóstica sencilla, a la vez que reduce el tiempo de diagnóstico complementario por método doppler.
1. Dettweiler D K, Patterson D F. The prevalence and types of cardiovascular disease in dogs. Annals of the New York Academy of Sciences. 1965 Sept; 127(1):481-516 https://doi.org/10.1111/j.1749-6632.1965.tb49421.x
2. Atkins C, Bonagura J, Ettinger S, Fox P, Gordon S, Haggstrom J, et al. Guidelines for the Diagnosis and Treatment of Canine Chronic Valvular Disease. ACVIM Consensus Statement J. Vet. Intern. Med. 2009 Oct; 23 (6):1142-1150. Doi: 10.1111/j.1939-1676.2009.0392.x
3. Paige CF, Abbott JA, Elvinger F, Pyle RL. Prevalence of cardiomyopathy in apparently healthy cats. J Am Vet Med Assoc. 2009 Jun 1; 234(11):1398-403. doi: 10.2460/ javma.234.11.1398.
4. Wagner T, Fuentes VL, Payne JR, McDermott N, Brodbelt D. Comparison of auscultatory and echocardiographic findings in healthy adult cats. J Vet Cardiol. 2010 Dec; 12(3):171-82. doi: 10.1016/j.jvc.2010.05.003.
5. Payne J R, Brodbelt D C, Fuentes V L. 2015. Cardiomyopathy prevalence in 780 apparently healthy cats in rehoming centres (the CatScan study). J Vet Cardiol. 2015; 17:S244-S257 https://doi.org/10.1016/j.jvc.2015.03.008
6. Keene BW, Atkins CE, Bonagura JD, Fox PR, Häggström J, Fuentes VL, Oyama MA, Rush JE, Stepien R, Uechi M. ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. J Vet Intern Med. 2019 May; 33(3):1127- 1140. doi: 10.1111/jvim.15488.
7. Fuentes V, Abbott J, Chetboul V, Côté E, Fox PR, Häggström J, Kittleson MD, Schober K, Stern JA. ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med. 2020 May; 34(3):1062- 1077. doi: 10.1111/jvim.15745.
8. Kittleson M D, Kienle R D. Medicina cardiovascular de pequeños animales. 2° Edición. España: Multimédica; 2000.
9. Ettinger S J, Feldman C. Tratado de Medicina Interna Veterinaria. Enfermedades del Perro y el Gato. 6º Ed. Elsevier Saunders; 2007
10. Bonagura J D, Fuentes V F. Echocardiography. En: Mattoon J S, Nyland T G. Small Animal Diagnostic Ultrasound. 3° Ed. Multimédica Ediciones Veterinarias; 2015. 217-332.
11 . de Madron E, Chetboul V, Bussadori C. Clinical Echocardiography of the Dog and Cat.. Elsevier Saunders; 2016.
12. Campbell F E. Cardiac Effects of Pulmonary Disease. The Veterinary Clinics of North America: Small Animal Practice. 2007; 37(5):949-962. doi:10.1016/j. cvsm.2007.05.006
13. Reinero C, Visser LC, Kellihan HB, Masseau I, Rozanski E, Clercx C, Williams K, Abbott J, Borgarelli M, Scansen BA. ACVIM consensus statement guidelines for the diagnosis, classification, treatment, and monitoring of pulmonary hypertension in dogs. J Vet Intern Med. 2020 Mar; 34(2):549-573. doi: 10.1111/jvim.15725.
14. Bonagura J D, Miller M W. Veterinary echocardiography. American Journal Cardiology Ultrasound & Allied Tech. 1989; 6(3):299-264. https://doi.org/ 10.1111/j.1540-8175.1989.tb00304.x
15. Boon J A. Ecocardiografía Veterinaria. 2° Edición. España. Multimédica; 2012
16. Chan IP, Weng MC, Hsueh T, Lin YC, Lin SL. Prognostic value of right pulmonary artery distensibility in dogs with pulmonary hypertension. J Vet Sci. 2019 Jul; 20 (4):e34. doi: 10.4142/jvs.2019.20.e34.
17. Lee Y, Choi W, Lee D, Chang J, Kang JH, Choi J, Chang D. Correlation between caudal pulmonary artery diameter to body surface area ratio and echocardiography-estimated systolic pulmonary arterial pressure in dogs. J Vet Sci. 2016 Jun 30;17(2):243-51. doi: 10.4142/jvs.2016.17.2.243.
18. Rhinehart JD, Schober KE, Scansen BA, Yildiz V, Bonagura JD. Effect of Body Position, Exercise, and Sedation on Estimation of Pulmonary Artery Pressure in Dogs with Degenerative Atrioventricular Valve Disease. J Vet Intern Med. 2017 Nov; 31(6):1611- 1621. doi: 10.1111/jvim.14814.
19. Bonagura J D, Miller M W, Darke P G. Doppler Echocardiography. I. Pulsed-wave and Continuous-Wave Examinations. The Veterinary Clinics of North America: Small Animal Practice. 1998; 28 (6):1325-1359 DOI: 10.1016/s0195-5616(98)50126-x
20. Soydan LC, Kellihan HB, Bates ML, Stepien RL, Consigny DW, Bellofiore A, Francois CJ, Chesler NC. Accuracy of Doppler echocardiographic estimates of pulmonary artery pressures in a canine model of pulmonary hypertension. J Vet Cardiol. 2015 Mar; 17(1):13-24. doi: 10.1016/j.jvc.2014.10.004.
21. Jonhson L. Diagnosis of Pulmonary Hypertension.Vet Clin Northam Small Anim. pract. 1999; 14 (4):231-236 DOI: 10.1016/S1096-2867(99)80016-4.
22. Visser LC, Im MK, Johnson LR, Stern JA. Diagnostic Value of Right Pulmonary Artery Distensibility Index in Dogs with Pulmonary Hypertension: Comparison with Doppler Echocardiographic Estimates of Pulmonary Arterial Pressure. J Vet Intern Med. 2016 Mar-Apr;30(2):543-52. doi: 10.1111/jvim.13911. Epub 2016 Feb 19. PMID: 26893108; PMCID:
23. Kirberger R M, Bland-vanden Berg P, Darazs B. Doppler echocardiography in the normal dog: Part I, Velocity findings and flow patterns. Vet. Radiol. Ultrasound. 1992; 33 (6):370-379. https://doi.org/10.1111/j.1740-8261.1992.tb00162.x
24. Brown DJ, Knight DH, King RR. Use of pulsed-wave Doppler echocardiography to determine aortic and pulmonary velocity and flow variables in clinically normal dogs. Am J Vet Res. 1991 Apr; 52(4):543-50. https://pubmed.ncbi.nlm.nih.gov/2053722/
25. Yuill CD, O’Grady MR. Doppler-derived velocity of blood flow across the cardiac valves in the normal dog. Can J Vet Res. 1991 Apr;55(2):185-92. PMID: 1884300
26. Gaber C. Doppler echocardiography. Probl Vet Med. 1991 Dec; 3(4):479-99. https:// pubmed.ncbi.nlm.nih.gov/1802267/
27. Vezzosi T, Domenech O, Iacona M, Marchesotti F, Zini E, Venco L, Tognetti R. Echocardiographic Evaluation of the Right Atrial Area Index in Dogs With Pulmonary Hypertension. J. Vet. Intern. Med . 2018; 32 (1):42-47 DOI:10.1111/jvim.15035.
28. Serres FJ, Chetboul V, Tissier R, Carlos Sampedrano C, Gouni V, Nicolle AP, Pouchelon JL. Doppler echocardiography-derived evidence of pulmonary arterial hypertension in dogs with degenerative mitral valve disease: 86 cases (2001-2005). J Am Vet Med Assoc. 2006 Dec 1; 229(11):1772-8. doi: 10.2460/javma.229.11.1772
29. Paige CF, Abbott JA, Pyle RL. Systolic anterior motion of the mitral valve associated with right ventricular systolic hypertension in 9 dogs. J Vet Cardiol. 2007 May; 9(1):9- 14. doi: 10.1016/j.jvc.2006.08.003.
30. Venco L, Mihaylova L, Boon JA. Right Pulmonary Artery Distensibility Index (RPAD Index). A field study of an echocardiographic method to detect early development of pulmonary hypertension and its severity even in the absence of regurgitant jets for Doppler evaluation in heartworm-infected dogs. Vet Parasitol. 2014 Nov 15; 206(1- 2):60-6. doi: 10.1016/j.vetpar.2014.08.016. Epub 2014 Sep 1
31. Abbott JA, Gentile-Solomon JM. Measurement Variation and Repeatability of Echocardiographic Variables Used to Estimate Pulmonary Artery Pressure in Dogs. J Vet Intern Med. 2017 Nov; 31(6):1622-1628. doi: 10.1111/jvim.14846
32. Borgarelli M, Abbott J, Braz-Ruivo L, Chiavegato D, Crosara S, Lamb K, Ljungvall I, Poggi M, Santilli RA, Haggstrom J. Prevalence and prognostic importance of pulmonary hypertension in dogs with myxomatous mitral valve disease. J Vet Intern Med. 2015 Mar-Apr; 29(2):569-74. doi: 10.1111/jvim.12564.
33. Schober KE, Baade H. Doppler echocardiographic prediction of pulmonary hypertension in West Highland white terriers with chronic pulmonary disease. J Vet Intern Med. 2006 Jul-Aug; 20(4):912-20. doi: 10.1892/0891-6640(2006)20[912:depoph]2.0.co;2.
34. Paradies P, Spagnolo PP, Amato ME, Pulpito D, Sasanelli M. Doppler echocardiographic evidence of pulmonary hypertension in dogs: a retrospective clinical investigation. Vet Res Commun. 2014 Mar; 38(1):63-71. doi: 10.1007/s11259-013-9588-4
35. Akabane R, Shimano S, Sakatani A, Ogawa M, Nagakawa M, Miyakawa H, Miyagawa Y, Takemura N. Relationship between right heart echocardiographic parameters and invasive pulmonary artery pressures in canine models of chronic embolic pulmonary hypertension. J Vet Med Sci. 2019 Oct 24; 81(10):1485-1491. doi: 10.1292/ jvms.19-0350.
36. Johnson LR, Stern JA. Clinical features and outcome in 25 dogs with respiratory-associated pulmonary hypertension treated with sildenafil. J Vet Intern Med. 2020 Jan; 34(1):65-73. doi: 10.1111/jvim.15679.
37. Uehara Y. An attempt to estimate the pulmonary artery pressure in dogs by means of pulsed Doppler echocardiography. J. Vet. Sci. 1993; 55(2):307–312 doi: 10.1292/ jvms.55.307
38. Ristic JM, Marin CJ, Baines EA, Herrtage ME. Congenital Pulmonic Stenosis a Retrospective study of 24 cases seen between 1990-1999. J Vet Cardiol. 2001 Nov; 3(2):13- 9. doi: 10.1016/S1760-2734(06)70015-7.
39. Tobias AH, Stauthammer CD. Minimally invasive per-catheter occlusion and dilation procedures for congenital cardiovascular abnormalities in dogs. Vet Clin North Am Small Anim Pract. 2010 Jul;40(4):581-603. doi: 10.1016/j.cvsm.2010.03.009
40. Francis A J, Johnson M J, Culshaw G C, Corcoran B M, Martin M W S, French A T. Outcome in 55 dogs with pulmonic stenosis that did not undergo balloon valvuloplasty or surgery. J.Small Anim. Pract.. 2011; 52(6):282–288 https://doi. org/10.1111/j.1748-5827.2011.01059.x
41. Johnson M S, Martin M, Edwards D, French A, Henley W. Pulmonic stenosis in dogs: balloon dilation improves clinical outcome. J.Vet. Intern. Med. 2004; 18 (5):656-62 doi: 10.1892/0891-6640(2004)18<656:psidbd>2.0.co;2.
42. Loureiro J, Smith S, Fonfara S, Swift S, James R, Dukes-McEwan J. Canine dynamic left ventricular outflow tract obstruction: assessment of myocardial function and clinical outcome. J Small Anim Pract. 2008 Nov; 49(11):578-86. doi: 10.1111/j.1748-5827.2008.00623.x.
Fecha recepción: 14/02/2021
Fecha de aceptación para su publicación: 31/05/2021