DOI: http://dx.doi.org/10.19137/cienvet-201921102
![]() Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No
Comercial-Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias
Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No
Comercial-Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias
ARTÍCULO DE INVESTIGACIÓN
Inmunodetección de Wingless int-3 (Wnt3) en la reparación de defectos óseos ortopédicos en conejos tratados con matriz ósea desmineralizada
Wingless int-3 (Wnt3) Immunodetection in the repair of orthopedic bone defects in rabbits treated with demineralized bone matrix
Audisio, S.A.1; Vaquero, P.G1; Verna, E.C.1; Cristofolini, A.L.2; Merkis, C.I.2
1 Cátedra Técnica y Patología Quirúrgica – Facultad de Ciencias Veterinarias, UNLPam,
Calle 5 y 116, General Pico (6360), La Pampa, Argentina.
2 Área Microscopía Electrónica - Facultad de Agronomía y Veterinaria, UNRC, Río Cuarto,
Córdoba, Argentina
Correo electrónico: saudisio@vet.unlpam.edu.ar
Resumen: Si bien la expresión de Wnt y sus isoformas se conocen ampliamente
en la esqueletogénesis embrionaria, poco se sabe del rol que desempeña,
en particular la isoforma Wnt3, en la reparación de defectos óseos ortopédicos. Se emplearon 30 conejos a los que se les practicó a
cada uno, un defecto óseo en sus miembros torácicos , el que se procedió a rellenar con matriz ósea desmineralizada (MOD). Los conejos
fueron sacrificados a los 7, 15, 21, 30, 60 y 150 días post-tratamiento
para realizar inmunodetección de Wnt3 en los sitios de reparación.
La inmunodeterminación se efectuó mediante densidad óptica (DO) y
densidad óptica integrada (DOI). Las DO y DOI se analizaron mediante
ANOVA y Test LSD de Fisher. La proteína Wnt3 se inmunodetectó en
células mesenquimáticas, en los sitios donde se produjo la condrogénesis
y en células osteoprogenitoras, preosteoblastos y osteoblastos.
La DO tuvo variaciones significativas (p<0,05) a los 7,15, 60 y 150 días
post-tratamiento. El mismo análisis estadístico para DOI señaló que
hubo diferencias estadísticamente significativas (p<0,05) a los 30 días
respecto a los 60 y 150 días. La evidencia expuesta mostró los sitios
histológicos como así también la cronología de expresión de Wnt3 en
la reparación de defectos óseos ortopédicos tratados con matriz ósea
desmineralizada.
Palabras clave: Wnt ; Matriz ósea desmineralizada ; Hueso ; Conejo ;
Inmunomarcación
Summary: Although the expression Wnt and its isoforms are widely known
in the embryonic skeletogenesis, little is known about the role they
play in the particular Wnt3 isoform in the repair of orthopedic bone
defects. Thirty rabbits were used, which were given a bone defect in
one of the radiuses. The defect was refilled with demineralized bone
matrix (DBM). The rabbits were sacrificed at 7, 15, 21, 30, 60 and 150
days post-treatment to immuno-detect the Wnt3 in the repair sites.
The immuno-determination was done by optic density (OD) and integrated
optic density (IOD). Both, the OD and the IOD were analyzed
using ANOVA and Fisher LSD test. The Wnt3 protein was immuno-detected
in mesenchymal cells, in the sites where the chondrogenesis
was produced and in osteoprogenitor, preosteoblasts and osteoblasts
cells. The OD had significant variations (p<0,05) at 7, 15, 60 and 150
days post-treatment. The same statistical analysis for IOD showed significant
statistical differences (p<0,05) at day 30 with respect to 60
and 150 days post-treatment. The evidence showed the histological
sites as well as the chronological immune expression of Wt3 in the
repair of orthopaedic bone defects treated with demineralized bone
matrix.
Key words: Wnt ; Demineralized bone matrix ; Rabbit ; Bone ;
Immunostaining
La matriz ósea desmineralizada (MOD) es utilizada en cirugía veterinaria
debido a su propiedad osteoinductiva(1). Por esa razón se
la suele emplear con el fin de reparar fracturas, resolver no uniones,osteomielitis y rellenar defectos como consecuencia del tratamiento
de neoplasias(2,3,4,5).
La MOD se encuentra constituida por los elementos orgánicos que conforman la matriz ósea. Entre ellos se hallan el colágeno Tipo
I, la proteína morfogénica del hueso (BMP), osteocalcina (OC), osteopontina
(OPN), sialoproteína ósea BSP, (por su sigla en inglés) y
osteonectina(6,7).
La proteína Wingless-int (Wnt) conforma una familia de glicoproteína
que se encuentra implicada en el desarrollo embrionario,
la inducción de tejido, la polaridad axial(8,9) y la tumorigénesis(10). Es
reguladora de la formación de hueso junto a la hormona paratiroide,
prostaglandinas y BMP. Impulsa la diferenciación de las células mesenquimales
(CM) en osteoblastos(10), la diferenciación en osteoblastos(11), en condrocitos(12) y regula la masa ósea(13).
Wnt acciona sobre las células a través de las vías canónica y no canónica.
La via canónica es la que mejor se conoce(14,15,16) esta proteína
actúa impidiendo la degradación de la β-catenina citosólica, evitando
así que la misma intervenga sobre el ADN en el núcleo celuar e induciendo
la proliferación y diferenciación celular. Mientras que la vía no
canónica utiliza mediadores diferentes para expresarse.(17)
El objetivo del presente artículo, según protocolo previamente informado
por autores(18), consistió en establecer y cuantificar la presencia
espacial y temporal de Wnt3 en el proceso de reparación de
defectos óseos ortopédicos tratados con MOD procesada.
Se emplearon 30 conejos machos y hembras sexualmente maduros
a los que se les brindaron cuidados de manejo según las normas
de la Facultad de Ciencias Veterinarias de la Universidad Nacional de
La Pampa. Los animales fueron mantenidos en jaulas individuales,
alimentados con una fórmula balanceada y agua ad-libitum. Luego de
un período de acostumbramiento a las condiciones de alojamiento se
procedió a realizar la experiencia.
Ante la falta en el momento de realizar el trabajo de reglamentación
de ética animal para el abordaje experimental, se confeccionó expreso un protocolo siguiendo normas internacionales avaladas por
las Facultades de Ciencias Veterinarias de las Universidades de La
Plata y Río Cuarto.
Los conejos fueron sedados con 0,1 mg/kg de diazepam (Diazepam®,
Lab Zoovet, Arg), 0,01 mg/kg IM de acepromacina (Acedan®, Lab
Holliday, Arg) y anestesiados con 40 mg/kg IM de ketamina (ketamina 50®, Lab Holliday, Arg). A cada animal le fue acondicionado uno de los
miembros torácicos para ser intervenidos en condiciones de asepsia.
Se abordaron las diáfisis radiales a través de la cara dorsal del antebrazo
donde se creó un defecto que por sus mínimas dimensiones no cura
de forma espontánea en la vida del animal(19), equivalente a dos veces
el diámetro de la diáfisis(20).
La MOD se obtuvo de procesar diáfisis óseas provenientes de huesos
largos de conejos según protocolo previamente informado(18).
Brevemente, la técnica consistió en extraer los tejidos blandos de los
huesos a 4ºC. Las diáfisis se fragmentaron hasta obtener partículas de
100 a 750 μm. Al hueso fragmentado le fueron extraídos los lípidos
con una solución de cloroformo:metanol y luego se desmineralizó con ácido clorhídrico (HCl) 0,6N. Una vez estabilizado el pH en 7,0 se conservó en alcohol etílico 95º a 4ºC hasta su uso.
Luego de rellenar los defectos con la MOD, se suturaron los músculos
extensores con poligalactina (Vicryl®, Ethicon, USA) y el tejido
subcutáneo y piel según técnicas de rutina. Luego de las intervenciones
los conejos recibieron 1.000.000 IU de bencilpenicilina y dihidroestreptomicina
(Dipenisol®, Lab. Bayer, Arg.) y antiinflamatorios
no esteroides, (Ketofen 0,1 mg/kg (Kalmavet®, Lab Vetanco, Arg) por
3-5días.
Los conejos fueron sacrificados a los 7, 15, 21, 30, 60 y 150 días
post-operatorio en grupos de 5 animales. De cada cadáver se recuperaron
las porciones de las diáfisis que contenían los defectos tratados.
Las muestras se fijaron con formol salino tamponado, se deshidrataron
con baterías de alcoholes de graduación creciente, para ser incluidos
en parafina. Se realizaron cortes histológicos correspondiente a los
defectos provocados y tratados de aproximadamente 4 μm con micrótomo
(Microtom®, USA) y montaron 3-4 cortes sobre cada portaobjeto.
Los cortes histológicos se trataron con peróxido de hidrógeno al
3% (v/v), luego se lavaron con PBS y posteriormente se incubaron con
el anticuerpo para Wnt3 (H-70): sc-28824 dilución 1/200; Santa Cruz
Biotechnology, Inc, USA) durante 1 hora a temperatura ambiente en
cámara húmeda. Posteriormente fueron lavados con solución tampón
fosfato salino (PBS pH 7,2) e incubados durante 20 minutos con el segundo
anticuerpo biotinilado (compuesto por inmunoglobulinas biotiniladas
anti-conejo, anti-ratón y anti-cabra). Luego de ser nuevamente
lavados con PBS fueron tratados con el complejo de streptavidina
conjugada con peroxidasa (LSAB®+Systems HRP, Dako Cytomation).
Luego del período de incubación fueron lavados y tratados con la solución
de sustrato cromógeno 3,3`-diaminobenzidina (DAB). Con posteridad
los cortes fueron contrastados con hematoxilina de Mayer, lavados con solución de hidróxido de amonio, deshidratados en batería
de alcoholes de concentración creciente y montados con Entellan
(Merck, Alemania).
La expresión de Wnt3 se estableció positiva cuando se tiñó de color
marrón la matriz extracelular y citoplasma de células mesenquimáticas,
osteoblastos, osteocitos y osteoclastos.
Se capturaron imágenes de los cortes inmunomarcados con aumento
200X con un microscopio óptico Axiophot (Carl Zeis, Alemania) acoplado
a una cámara digital Powershot (G6, 7.1 megapixeles, Canon INC,
Japón) que empleó el software AxioVision 4.6.3 (Carl Zeis, Alemania).
Las imágenes tomadas correspondieron a las partículas de MOD, tejido
osteocondroide, a la fase de osificación y del hueso nuevo trabecular
y hueso maduro. Las imágenes se analizaron según metodología
previamente informada por Vasconcellos et al.(21)
La inmunomarcación de Wnt3 se cuantificó calculando la densidad óptica (DO) y densidad óptica integrada (DOI). Para estimar las DO y
DOI las imágenes capturadas de los cortes histológicos se introdujeron
en el software ImageJ 1.49b (Media Cybernetics, USA). Éste convirtió el color marrón de la expresión de BMP-2 en grises en una escala que
se extiende de 0 a 255 (el 0 corresponde al blanco y el número 255 al
negro). La densidad óptica se calculó según la fórmula DO=Log10 (IT/
II); la IT es la intensidad transmitida (equivale a 255) y la II que es la
intensidad incidente, que se corresponde a la media de grises en la
imagen analizada por el software. La densidad óptica integrada (DOI)
se obtiene del producto entre la DO y la unidad de superficie expresada
en micras cuadradas (μ2) ocupada por la expresión de Wnt3, según
la fórmula DOI=(DO *AREA). El resultado de ambas fórmulas se expresó en unidades arbitrarias (UA).
Los datos obtenidos se introdujeron en el software Infostat(22) con
los cuales se realizó estadística descriptiva. Las medias de cada período
de estudio se las analizó con ANOVA y test de LSD de Fisher para
comparar múltiples grupos. La significación estadística se definió como p<0,05.
A los 7 días post-operatorio la proteína Wnt3 se inmunodetectó en
las células mesenquimáticas (CM) ocupando los espacios entre las partículas
de MOD (Figura N°1). La DO para Wnt3 fue 0,10 (±0,05; min:0,04-
máx:0,21) y la DOI 3,15 (±4,66; min: 0,09-máx: 21,07) (Tabla N°1).
Tabla N°1. Densidad óptica (DO) y densidad óptica integrada (DOI) de Wnt3 en
los períodos estudiados
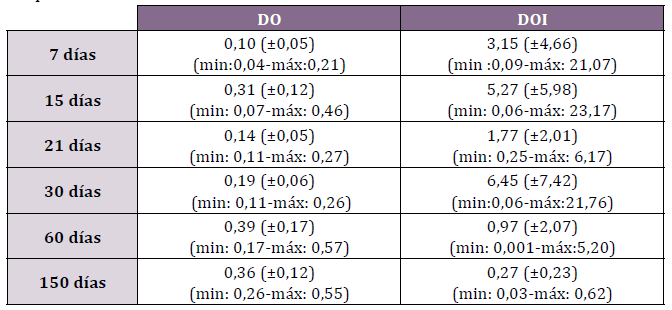
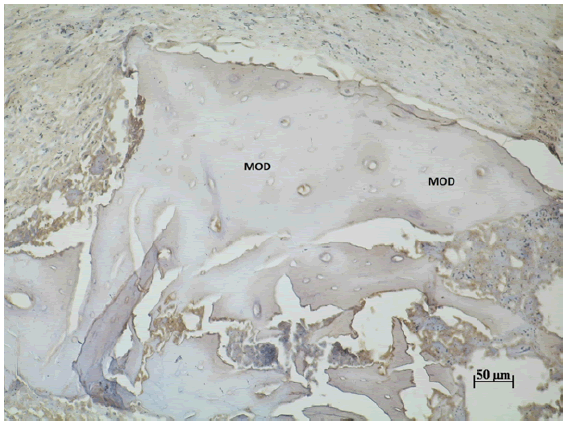
Figura Nº1. Inmunodetección de Wnt3 en las partículas de MOD a los 7 días
post-tratamiento. 200X.
Luego de 15 días de tratamiento Wnt3 inmunomarcó en las CM que
rodeaban a las partículas de MOD (Figura N°2), en los sitios donde se
llevaba a cabo la condrogénesis, en los condrocitos y en los sitios de
osificación (Figura N°3).
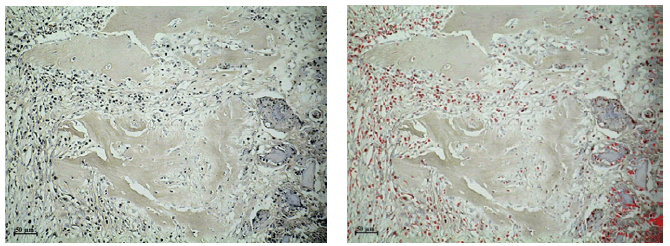
Figura N°2. IHQ Wnt3 de tejido de reparación de defectos óseos tratados con
MOD. Las partículas de MOD se hallan rodeadas por células mesenquimáticas
inmunomarcadas (izquierda). Análisis digital de la misma imagen muestra en
color rojo las células marcadas (derecha) IHQ 200X.
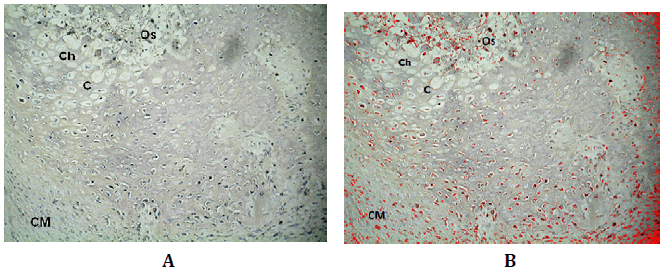
Figura N°3. Inmunodetección de Wnt3. A) de tejido de reparación de defectos óseos
tratados con MOD. En la micro fotografía superior se manifiesta la inmunomarcación
de Wnt3 en células mesenquimáticas (CM), cartílago (C), condrocitos hipertróficos
(Ch) y sitio de osificación (Os). B) Análisis digital de la misma microfotografía
en la que se muestra en rojo la presencia de Wnt3. 200X.
En sectores donde predominaban espículas óseas nuevas inmunoseñaló en las células osteoprogenitoras, condrocitos hipertróficos,
preosteoblastos, osteoblastos y osteocitos (Figura Nº4).
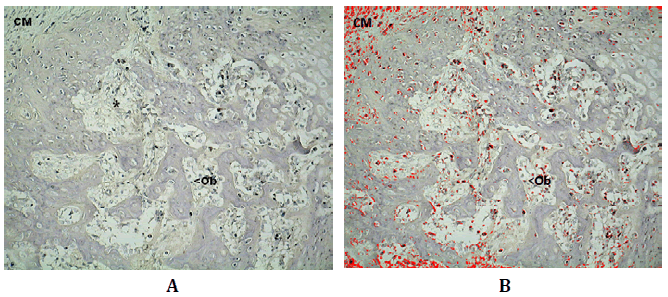
Figura N°4. Inmunomarcación de Wnt3 de en corte histológico de un sector de
reparación conteniendo espículas neoformadas. En la fotografía superior, en el ángulo
superior izquierdo se observan células mesenquimáticas (CM), espículas en
centro de la imagen sobre las que se depositan osteoblastos (Ob); entre los espacios
formados por las espículas las células osteoprogenitoras (*) y los pre osteoblastos
marcados en rojo como producto del análisis digital de la microfotografía. 200X
La DO para Wnt3 fue 0,31 (±0,12; min: 0,07-máx: 0,46) y la DOI
5,27 (±5,98; min: 0,06-máx: 23,17) (Tabla Nº1).
Hacia los 21 días post-tratamiento la proteína Wnt3 inmunoexpresó en las CM y en las células precursoras de tejido condral. En los condroplastos
y condroceles; y aisladamente en condrocitos hipertróficos
que se encontraban cercanos a los lugares de osificación (Figura N°5).
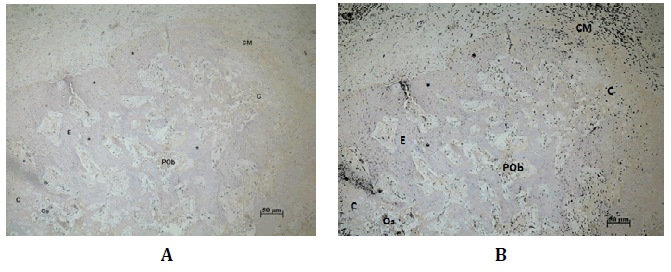
Figura Nº5. Inmunodetección de Wnt3 a los 21 días. A) En sector de espículas óseas nuevas. Wnt3 inmunoseñala en las CM, tejido cartilaginoso (C), condrocitos
(Co), condrocitos hipertróficos próximos a los sitios de osificación (Os),
preosteoblastos (POb) que se encontraban entre las trabéculas (E), y en osteocitos
(Oc) trabeculares. B) Análisis digital de la misma microfotografía, en negro
se destaca la presencia de Wnt3. 200X.
La DO y DOI a en este período de reparación fue 0,14 (±0,05; min:
0,11-máx: 0,27) y 1,77 (±2,01; min: 0,25-máx: 6,17) respectivamente
(Tabla Nº1)
Luego de 30 días, Wnt3 se halló en los osteoblastos y preosteoblastos
(Figura Nº6).
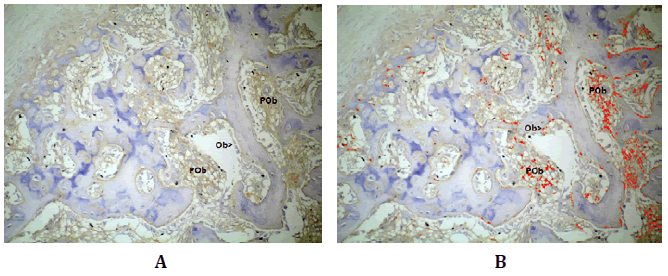
Figura Nº6. Inmunomarcación de Wnt3. A) Inmunolocalización de Wnt3 en los
osteoblastos presentes en la superficie de las trabéculas y en los preosteoblastos
que se encuentran en los espacios intertrabeculares; B) análisis digital de la
microfotografía A, en rojo se destaca Wnt3. 200X.
El análisis de las densidades fue DO 0,19 (±0,06; min: 0,11-máx:
0,26) y DOI 6,45 (±7,42; min: 0,06-máx:21,76) (Tabla N°1).
A los 60 días post-operatorio, Wnt3 se inmunomanifestó en los osteocitos
y células de la médula ósea presente entre los espacios trabeculares
(Figura Nº7).
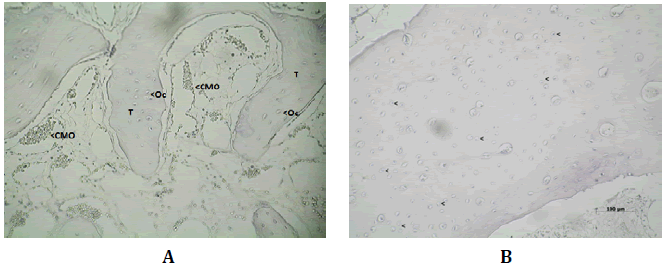
Figura Nº7. A) Inmunomarcación de Wnt3 en las trabéculas (T) óseas, osteocitos
(Oc) y células de la médula ósea a los 60 días post-operatorio. 100X. B)
Inmunomarcación para Wnt3 luego de 150 días post-tratamiento. Wnt3 se encuentra
en ciertos osteocitos y células de la médula ósea. 200X.
La DO registrada fue 0,39 (±0,17; min: 0,17-máx: 0,57) y la DOI 0,97
(±2,07; min: 0,001-máx:5,20) (Tabla N°1).
Luego de 150 días Wnt3 se encontró en escasos osteocitos y en
las células de la médula ósea presente en los espacios trabeculares
(Figura N°8).
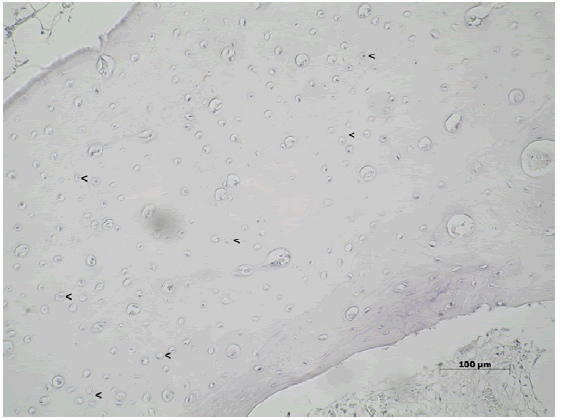
Figura Nº8. Inmunomarcación para Wnt3 luego de 150 días post-tratamiento.
Wnt3 se encuentra en ciertos osteocitos y células de la médula ósea. 200X.
La DO fue 0,36 (±0,12; min: 0,26-máx: 0,55) y DOI 0,27 (±0,23; min:
0,03-máx: 0,62) (Tabla Nº1).
El análisis ANOVA y test comparativo LSD de Fisher para las DO,
generó tres grupos de clasificación, el primero incluyó a las medias
obtenidas de los 15, 60 y 150 días; el segundo grupo lo constituyeron
las medias de los 21 y 30 días y el tercer grupo las medias de los 7 y
21 días. La DO tuvo diferencia estadísticamente significativa (p<0,05)
entre el grupo de clasificación 1 (15, 60 y 150 días) con el grupo de
clasificación 2 (21 y 30 días), en tanto que la DO a los 7 días poseía
diferencia significativa (p<0,05) con las medias los grupos 1 y 2 (a excepción
de los 21días). El mismo análisis estadístico para DOI señaló que hubo diferencias estadísticamente significativas (p<0,05) a los 30
días respecto a los 60 y 150 días.
Si bien los mecanismos y vías de señalización de Wnt3 durante la
esqueletogénesis en la vida embrionaria se encuentran ampliamente
estudiados(18), poco se conoce del rol que cumple en la reparación
de fracturas. Se sabe que las isoformas Wnt4, Wnt5a, Wnt5b, Wnt10b,
Wnt11, Wnt13 se expresan en la reparación de las fracturas a través de
la vía canónica de β-catenina(23,24).
La expresión de Wnt3 a los siete días post-implante es un resultado
que era previsible pues ocurre de forma similar tal como ocurre en
la esqueletogénesis embrionaria(25). En la reparación de los defectos óseos tratados con MOD se inmunomanifestó en las CM sobre las que
actuó promoviendo la proliferación y diferenciación de esas células.
La expresión de Wnt3 habría respondido a la activación de sus vías
de señalización no canónicas que induce BMP-2(26). Así, ambas proteínas
operan reclutando a las CM mediante el factor de crecimiento
del tejido conectivo (CTFG)(27, 11) La acción conjunta de BMP-2 y
Wnt3 influyó en la condensación, agregación, proliferación y diferenciación
celular observados en esta experiencia y que fueran descriptos
en la embriogénesis, en estudios in vitro y en la reparación de las
fracturas(28,29,30,24,31,25).
En concordancia con Fischer et al., (2002)(27) observamos que la
isoforma Wnt3 intervino en la condrogénesis, aunque no se expresó en la fase de maduración de los condrocitos. Avanzada la diferenciación
de los condrocitos, Wnt3 nuevamente se inmunoexpresó en los
condrocitos hipertróficos. Esta nueva expresión, respondería a la activación
del factor de transcripción Runx2(32).
Las características de la osificación observada, se corresponderían
con el modelo de osificación transcondral y no con el modelo de osificación
endocondral reportado en la reparación de las fracturas(33,34).
En la osificación transcondral los condrocitos hipertróficos se transdiferencian
en células osteo progenitoras sin que se produzca la apoptosis
de las mismas como sucede en la osificación endocondral(35,36).
La inmunomarcación de Wnt3 en los osteoblastos revela el rol que
posee en la proliferación y diferenciación de las células que integran el
linaje osteogénico. La expresión de Wnt3 en los osteoblastos responde
al rol que tienen de prevenir la desdiferenciación en condrocitos(37) ya que ésta es una forma también de transdiferenciación(38).
Wnt3 demostró una variada expresión en la reparación de defectos óseos ortopédicos tratados con MOD, semejante a lo que sucede durante
la esqueletogénesis en la vida embrionaria(39,40,41).
El estudio de la DO y DOI permitió establecer la presencia y/o ausencia
de Wnt3 y a la vez cuantificar el grado de expresión en las distintas
fases estudiadas. Las cuantificaciones contribuyeron a establecer
el grado de participación de cada proteína en el momento analizado.
Por otra parte, la expresión de Wnt3 inducida por la vía canónica
y por BMP-2 en las CM pluripotentes señaló el inicio de la cascada de
eventos de proliferación y diferenciación celular que concluyó en la
reparación de los defectos.
En el presente trabajo quedó demostrado que Wnt3 se inmunomanifestó en estadios de reparación cruciales como en la proliferación
y diferenciación de las células mesenquimáticas pluripotentes, en la
condrogénesis, en la diferenciación de preosteoblastos y osteoblastos
como así también en los sitios donde se llevó a cabo la osificación. La
evidencia expuesta mostró los sitios histológicos como así también la
cronología de expresión de Wnt3 en la reparación de defectos óseos
ortopédicos tratados con matriz ósea desmineralizada.
1. Urist, M.R. Bone formation by autoinduction. Science. 1965; 150: 893-899.
2. Ganesh, T.N. Comparative studies on bone grafting for radial fracture using autogeneic cancellous bone, allogeneic demineralized bone matrix and xenogeneic demineralized bone matrix for better osteogenesis in canines. Indian Journal of Veterinary Surgery. 1992; 14:1-48.
3. Kumar, R.V.S.; Ramakrishna, O. Femoral fracture repair by demineralized bone matrix combinations in canines. Indian Journal of Animal Sciences. 2001; 71:749-751.
4. Hoffer, M.J.; Griffon, D.J.; Schaeffer, D.J.; Johnson, A.L.; Thomas, MW. Clinical applications of demineralized bone matrix: a retrospective and case-matched study of seventy- five dogs. Veterinary Surgery. 2008; 37:639-647.
5. da Silva, S.W.G.; de Castro, R.P.; deViana, G.A.; dos Santos, F.R.; de Moraes, R.S.; do Oriente, V.N. Estenose de pelve em felino tratado com anel de matriz óssea desmineralizada (MOD) - relato de caso. Clínica Veterinária. 2012; 17:46-50.
6. Colnot, C.; Romero, D.M.; Huang, S.; Helms, J. Mechanism of action of demineralized bone matrix in the repair of cortical bone defects. Clinical Orthopaedic Related Research. 2005; 435:69-78.
7. Eppley, B.L.; Pietrzak, W.S.; Blanton, M.W. Allograft and alloplastic bone substitutes: a review of science and technology for the craniomaxillofacial surgeon. Journal of Craniofacial Surgery. 2005; 16:981-989.
8. Gavin, B.J.; McMahon, J.A.; McMahon, A.P. Expression of multiple novel Wnt-1/ int-1-related genes during fetal and adult mouse development. Genes Development. 1990; 4:2319–2332.
9. Cadigan, K.M.; Nusse, R. Wnt signaling: a common theme in animal development. Genes Development. 1997; 11:3286-3305.
10. Miller, J.R. The Wnts. Genome biology. 2002; 3:3001-3015.
11. Luo, Q.; Kang, Q.; Si, W; Jiang, W.; Park, J.K.; Peng, Y.; Li, X.; Luu, H.H.; Luo, J.; Montag, A.G.; Haydon, R.C.; He, T.C. Connective tissue growth factor (CTGF) is regulated by Wnt and bone morphogenetic proteins signaling in osteoblast differentiation of mesenchymal stem cells. Journal Biology Chemistry. 2004; 279:55958-55968.
12. Rodda, S.J.; McMahon, A.P. Distinct roles for Hedgehog and canonical Wnt signaling in specification, differentiation and maintenance of osteoblast progenitors. Development. 2006; 133:3231–3244.
13. Hartmann, C. A Wnt canon orchestrating osteoblastogenesis. Trends in Cell Biology. 2006; 16:151–158.
14. He, X.; Semenov, M.; Tamai, K.; Zheg, X. LDL receptor related proteins 5 and 6 in Wnt/b-catenin signaling: arrows point the way. Development. 2004; 131:1663–1677.
15. Kelly, O.G.; Pinson, K.I.; Skarnes, W.C. The Wnt co-receptors Lrp5 and Lrp6 are essential for gastrulation in mice. Development. 2004; 131:2803–2815.
16. Huang, H.; He, X. Wnt/beta-catenin signaling: new (and old) players and new insights. Current Opinion in Cell Biology. 2008; 20:119-125.
17. Sugimura, R.; Li, L. Noncanonical Wnt signaling in vertebrate development, stem cells, and diseases. Birth Defects Research. Part C. Embryo Today. 2010; 90:243-256.
18. Audisio, S.A.; Vaquero, P.G.; Torres, P.A.; Verna, E.C.; Ocampo, L.N.: Ratusnu, V.; Cristofolini, A.L.; Merkis, C.I. Obtención, caracterización y almacenamiento de matriz ósea desmineralizada. Revista de Medicina Veterinaria. 2014; 95:27-34.
19. Schmitz, J.P.; Hollinger, J.O. The critical size defect as an experimental model for craniomandibulofacial nonunions. Clinical Orthopaedic Related Research. 1986; 205:299-308.
20. Hollinger, J.O.; Kleinschmidt, J.C. The critical size defect as an experimental model to test bone repair methods. Journal of Craniofacial Surgery.1990; 1:60-68.
21. Vasconcellos, A.; Cisternas, C.; Paredes, M. Estudio inmunohistoquímico comparativo del receptor de estrógeno en tejido endometrial de ovejas razas Texel y Araucana. Int. J. Morphol.2014; 32:1120-1124.
22. Di Rienzo, J.A.; Casanoves, F.; Balzarini, M.G.; Gonzalez, L.; Tablada, M.; Robledo, C.W. InfoStat versión 2010 Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina.
23. Zhong, N.; Gersch, R.P.; Hadjiargyrou, M. Wnt signaling activation during bone regeneration and the role of dishevelled. in chondrocyte proliferation and differentiation. Bone.2006; 39:5–16.
24. Chen, Y.; Whetstone, H.C.; Youn, A.; Nadesan, P.; Chow, E.C.Y.; Lin, A.C.; Alman, B.A.β-catenin signaling pathway is crucial for bone morphogenetic protein 2 to induce new bone formation. Journal Biological Chemistry. 2007; 282:526-533.
25. Monroe, D.G.; McGee-Lawrence, M.E.; Oursler, M.J.; Westendorf, J.J. Update on Wnt signaling in bone cell biology and bone disease. Gene. 2011; 492:1-18.
26. Tu, X.; Joeng, K.S.; Nakayama, K.I.; Nakayama, K.; Rajagopal, J.; Carroll, T.J.; McMahon, A.P.; Long, F. Noncanonical Wnt signaling through G protein-linked PKCdelta activation promotes bone formation. Developmental Cell.2007; 12:113-127.
27. Fischer, L.; Boland, G.; Tuan, R.S. Wnt-3A Enhances bone morphogenetic protein- 2-mediated chondrogenesis of murine C3H10T1/2 mesenchymal cells. The Journal of Biological Chemistry. 2002; 277:30870–30878.
28. Rawadi, G.; Vayssière, B.; Dunn, F.; Baron, R.; Roman-Roman, S. BMP-2 controls alkaline phosphatase expression and osteoblast mineralization by a Wnt autocrine loop. Journal of Bone and Mineral Research. 2003; 18:1842–1853.
29. Fujita, T.; Azuma, Y.; Fukuyama, R.; Hattori, Y.; Yoshida, C.; Koida, M.; Ogita, K.; Komori, T. Runx2 induces osteoblast and chondrocyte differentiation and enhances their migration by coupling with PI3K-Akt signaling. Journal of Cell Biolgy. 2004; 166:85–95.
30. Phimphilai, M.; Zhao, Z.; Boules, H.; Roca, H.; Franceschi, R.T. BMP signaling is required for RUNX2-dependent induction of the osteoblast phenotype. J Bone and Mineral Research. 2006; 21:637–646.
31. Nelson, W.J. Regulation of cell-cell adhesion by the cadherin-catenin complex. Biochemistral Society Transactions. 2008; 36:149-155.
32. Dong, Y.F.; Soung do, Y.; Schwarz, E.M.; O’Keefe, R.J.; Drissi, H. Wnt induction of chondrocyte hypertrophy through the Runx2 transcription factor. Journal of Cellular Physiology. 2006; 208:77-86.
33. Marsell, R.; Einhorn, T.A. The biology of fracture healing. Injury. 2011; 42:551-555.
34. Bigham-Sadegh, A.; Oryan, A. Basic concepts regarding fracture healing and the current options and future directions in managing bone fractures. Internal Wound Journal. 2015; 12:238–247.
35. Gibson, G.J.; Kohler,W.J.; Schaffler, M.B. Chondrocyte apoptosis in endochondral ossification of chick sterna. Developmental Dynamics. 1995; 203.468-476..
36. Scammell, B.E.; Roach, H.I. A new role for the chondrocyte in fracture repair: Endochondral ossification includes direct bone formation by former chondrocytes. Journal of Bone and Mineral Research. 1996; 11:737–745
37. Hill, T.P.; Spater, D.; Taketo, M.M.; Birchmeier, W.; Hartmann, C. Canonical Wnt/β-catenin signaling prevents osteoblasts from differentiating into chondrocytes. Dev. Cell. 2005; 8:727–738.
38. Zhou, X.; von der Mark, K.; Henry, S.; Norton, W.; Adams, H.; de Crombrugghe, B. 2014. Chondrocytes transdifferentiate into osteoblasts in endochondral bone during development, postnatal growth and fracture healing in mice. PLoS Genet. 10, e1004820.
39. Moon, R.T.; Brown, J.D.; Torres, M. WNTs modulate cell fate and behavior during vertebrate development. Trends in Genetics. 1997; 13:157–162.
40. Hartmann C.; Tabin C.J. Dual roles of Wnt signaling during chondrogenesis in the chicken limb. Development. 2000; 127:3141–3159.
41. Church, V.; Nohno, T.; Linker, C.; Marcelle, C.; Francis-West, P. Wnt regulation of chondrocyte differentiation. Journal of Cell Science. 2002; 115:4809–4818.
Fecha de recepción artículo original: 06-06-2018
Fecha aceptación para su publicación: 10-04-2019