DOI: http://dx.doi.org/10.19137/cienvet202224208
![]() Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
ARTÍCULO DE REVISIÓN
Factores asociados a la liberación de
gonadotrofinas y ovulación después de la
administración exógena de GnRH en el Bos Taurus
Factors associated with gonadotropin release and
ovulation after exogenous administration of GnRH
in Bos Taurus
Fatores associados à liberação de gonadotrofina
e ovulação após administração exógena de GnRH
em Bos Taurus
Colazo MG1, Mapletoft RJ2
1 Agricultural, Food and Nutritional Science, University of Alberta, Edmonton, Canada
2 Western College of Veterinary Medicine, University of Saskatchewan, Saskatoon, Canada
Correo electrónico: colazo@ualberta.ca
RESUMEN La hormona liberadora de gonadotropina (GnRH) es un decapéptido,
sintetizado por las neuronas GnRH en el hipotálamo, que estimula
la síntesis y secreción de gonadotrofinas (hormonas folículo estimulante,
FSH y luteinizante, LH) de la hipófisis anterior o adenohipofisis.
Agonistas de GnRH con una estructura idéntica o similar a la natural
han estado disponible comercialmente desde la década del 70 y
han sido utilizadas en un principio para el tratamiento de quistes foliculares
y el mejoramiento de la fertilidad en el ganado vacuno (1). La ovulación de folículos ováricos después de la administración de GnRH
fue reportada por primera vez por Schams et al. (2) y Britt et al. (3), pero
no fue hasta la década del 90 cuando la GnRH se comenzó a utilizar
para controlar la dinámica folicular durante el ciclo estral del bovino.
Ahora sabemos que una nueva onda folicular emerge dentro de los
2 días después de la ovulación del folículo dominante presente en el
momento del tratamiento con GnRH (4,5). Este hallazgo facilitó el desarrollo
de protocolos de sincronización a base de GnRH en combinación
con prostaglandinas (PGF) que permiten la inseminación artificial a
tiempo fijo (IATF), sin necesidad de realizar detección de celo. Estos
protocolos a base de GnRH y PGF son parte del manejo reproductivo
bovino, sobre todo del ganado lechero, en muchos rodeos comerciales
del mundo. Existen numerosos protocolos a base de GnRH y PGF disponibles
para la sincronización del estro y la ovulación en el ganado,
varios de esos protocolos se han explicado y discutido en detalle en
otros artículos (6,7). El objetivo de esta revisión es describir los factores
asociados a la liberación de LH y respuesta ovulatoria posterior a la
administración de GnRH, dar a conocer información relevante sobre el
efecto de las hormonas esteroideas en la respuesta a la GnRH y, por último,
brevemente postular estrategias que podrían mejorar la eficacia
de los protocolos basados en la aplicación de GnRH y PGF.
Palabras Clave: Estrógeno, Progesterona, Liberación de LH,
Dinámica folicular, Inseminación artificial
ABSTRACT The gonadotropin-releasing hormone (GnRH) is a decapeptide,
synthesized by the GnRH neurons in the hypothalamus, which stimulates
the synthesis and secretion of gonadotrophins (follicle-stimulating
hormone, FSH and luteinizing hormone, LH) from the anterior
pituitary or adenohypophysis. GnRH agonists with a structure identical
or similar to nature have been commercially available since the
1970’s and were initially used for the treatment of follicular cysts and
the improvement of fertility in cattle (1). The ovulation of ovarian follicles
after GnRH administration was first reported by Schams et al. (2) and Britt et al. (3), but it was not until the 1990’s that GnRH began to
be used to control follicular dynamics during the bovine estrous cycle.
Studies have shown that a new follicular wave emerges within 2 days
after ovulation of the dominant follicle present at the time of GnRH
treatment (4,5). This finding facilitated the development of synchronization
protocols based on GnRH in combination with prostaglandins
(PGF) that allow fixed-time artificial insemination (FTAI), without the need for heat detection. These GnRH-based protocols are part of the
reproductive management, especially in dairy cattle, in many commercial
herds around the world. There are several GnRH and PGF-based
protocols available for estrus and ovulation synchronization in cattle,
most of these protocols have been explained and discussed in detail
in other publications (6,7). The objective of this review is to describe
the factors associated with the release of LH and ovulatory response
after the administration of GnRH, to present relevant information on
the effect of steroid hormones on the response to GnRH and, finally,
to briefly postulate strategies that could improve the efficacy of GnRH
and PGF-based protocols.
Key words: Estrogen, Progesterone, LH release, Follicular dynamics,
Artificial insemination
RESUMO O hormônio liberador de gonadotrofinas (GnRH) é um decapeptídeo,
sintetizado pelos neurônios GnRH no hipotálamo, que estimula a
síntese e secreção de gonadotrofinas (hormônio folículo-estimulante,
FSH e hormônio luteinizante, LH) da hipófise anterior ou adeno-hipófise.
Agonistas de GnRH com estrutura idêntica ou semelhante à natureza
estão disponíveis comercialmente desde a década de 1970 e
foram inicialmente utilizados para o tratamento de cistos foliculares
e melhoria da fertilidade em bovinos (1). A ovulação de folículos ovarianos
após a administração de GnRH foi relatada pela primeira vez
por Schams et al. (2) e Britt et al. (3), mas foi somente na década de 1990
que o GnRH começou a ser usado para controlar a dinâmica folicular
durante o ciclo estral bovino. Sabemos agora que uma nova onda folicular
surge dentro de 2 dias após a ovulação do folículo dominante
presente no momento do tratamento com GnRH. (4,5) Essa descoberta
facilitou o desenvolvimento de protocolos de sincronização baseados
em GnRH em combinação com prostaglandinas (PGF) que permitem a
inseminação artificial em tempo fixo (IATF), sem a necessidade de detecção
de cio. Esses protocolos baseados em GnRH e PGF fazem parte
do manejo reprodutivo de bovinos, especialmente bovinos leiteiros,
em muitos rebanhos comerciais ao redor do mundo. Existem inúmeros
protocolos baseados em GnRH e PGF disponíveis para sincronização
de estro e ovulação em bovinos, vários desses protocolos foram explicados
e discutidos em detalhes em outros artigos (6,7). O objetivo desta
revisão é descrever os fatores associados à liberação de LH e resposta
ovulatória após a administração de GnRH, apresentar informações relevantes
sobre o efeito dos hormônios esteroides na resposta ao GnRH e, por fim, postular brevemente estratégias que possam melhorar a
eficácia de protocolos baseados na aplicação de GnRH e PGF.
Palavras-chave: Estrogênio, Progesterona, Liberação de LH,
Dinâmica folicular, Inseminação artifícial
La GnRH es un decapéptido sintetizado en las neuronas hipotalámicas
y secretado de manera pulsátil en la eminencia media dentro
de un complejo vascular conocido como sistema porta hipotálamo-hipofisiario
que desciende hacia la adenohipófisis. La GnRH se une a su
receptor de membrana localizado en los gonadotropos de la adenohipófisis
y estimula la síntesis y secreción de LH y FSH, controlando así la foliculogénesis, gametogénesis y la esteroidogénesis. Para una más
completa revisión leer Perrett y McArdle, (8).
La administración de GnRH exógena produce incrementos agudos
de LH y FSH (9,10,11). La liberación de LH dura unas 4 a 6 horas aproximadamente
(más corta que la liberación endógena de LH que dura
entre 8 y 10 horas) y el pico de LH se detecta, en promedio, 2 h posterior
al tratamiento con GnRH (10,11), seguido de ovulación en aquellos
animales que tengan un folículo dominante ≥ 9 mm de diámetro al
momento del tratamiento (5). Aunque se propuso que la emergencia de
una nueva onda folicular (4,5) ocurriría dentro de los 2 días posterior a
la ovulación o la luteinización de un folículo dominante después del
tratamiento con GnRH (12), la emergencia fue sincrónica solo si se indujo
la ovulación del folículo dominante (5). Aunque no se ha estudiado
adecuadamente la aparición de luteinización en las células de la pared
folicular después de la administración de GnRH en animales cíclicos,
se ha observado luteinización en quistes foliculares después del tratamiento
con GnRH (13).
Existen varios factores que pueden afectar la liberación de LH y la
ovulación en respuesta al tratamiento con GnRH exógena, entre ellos
el uso de diferentes agonistas (lo discutiremos más adelante). Desde el
punto de vista práctico el factor más importante es el día del ciclo estral (5,14), donde la concentración de progesterona, estradiol y el tamaño
del folículo dominante son determinantes en la liberación de LH y ovulación en respuesta al tratamiento con GnRH. La concentración de
hormonas esteroideas (progesterona y estrógeno) circulantes afectan
la magnitud de la liberación de LH (15,16,17) y por otra parte la ovulación
está altamente relacionada con la presencia o no de receptores de LH
en las células de la granulosa (18). Aunque la respuesta ovulatoria a la
administración de GnRH fue mayor en los días 5 y del 15 al 18 del
ciclo estral cuando un folículo dominante ≥ 10 mm de diámetro se encuentra
presente (14), la ovulación no ocurrió consistentemente en la
vaquillonas que se esperaba que tuvieran un folículo dominante > 10
mm al momento del tratamiento (11). En el primer trabajo de Pursley et
al. (19), se reportó que la ovulación se produjo en aproximadamente el
55% de las vaquillonas frente al 85% de las vacas lecheras lactantes,
independientemente de la etapa del ciclo estral al momento del tratamiento
con GnRH. Otros estudios posteriores, revelaron que la respuesta
ovulatoria en vaquillonas rondaría el 30% y en vacas el 50%
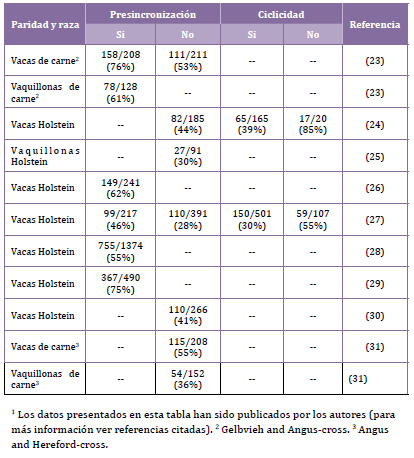
cuando son tratadas sin una previa presincronización (Tabla 1). Por
lo tanto, existe una marcada diferencia entre vacas y vaquillonas a la
respuesta ovulatoria después de la administración de GnRH (se discutirá más adelante). Consecuentemente, después del tratamiento con
GnRH, el desarrollo folicular no se controla de manera tan efectiva en
las vaquillonas en comparación con las vacas.
Los porcentajes de ovulación observados por nuestro grupo de trabajo
en vaquillonas y vacas de carne y leche después del tratamiento
con GnRH al inicio de un protocolo de sincronización son presentados
en la Tabla 1.
Como se mencionó anteriormente, la respuesta ovulatoria es marcadamente
más baja en vaquillonas que en vacas y el porqué de esta diferencia
no se ha elucidado todavía. Si bien existen diferencias fisiológicas
entre vacas y vaquillonas, tales como la concentración de progesterona
circulante y la dinámica folicular, que incitarían a especular que sean las
razones, hasta el momento ningún trabajo de investigación ha demostrado
que lo sean. En nuestro trabajo discutido en la sección anterior (16),
las concentraciones máximas de LH como el área bajo la curva en vaquillonas
con Baja y Alta concentración de progesterona circulante difirieron
significativamente de aquellas vacas que tenían alta concentración
de progesterona. Por lo tanto, la concentración de progesterona circulante
no pareciera ser el factor diferencial entre vacas y vaquillonas, por
el contrario, nuestros resultados sugerirían un mayor efecto supresor
de la progesterona sobre la hipófisis de la vaca.
Table 1. Respuesta ovulatoria en diferentes categorías de animales y razas que
fueron o no presincronizados y estaban o no ciclando posterior a un protocolo
de sincronización basado en GnRH1.
Si bien hay diferencias en cuanto a la dinámica folicular entre vacas
y vaquillonas Bos Taurus, cabe aclarar que no todas las vacas son
de dos ondas foliculares ni tampoco las vaquillonas lo son de 3 ondas
foliculares y que ha habido discrepancia entre reportes en cuanto a la
proporción de 2 y 3 ondas foliculares en vacas y vaquillonas. Sin embargo,
podríamos proponer que las vacas Bos Taurus son predominantemente
de dos ondas foliculares y los ciclos de tres ondas foliculares
parecen ser más frecuentes en vaquillonas. A pesar de esta modesta diferencia, es improbable que la dinámica folicular sea la razón principal
de la diferencia en la respuesta ovulatoria a la GnRH observada
entre vaquillonas y vacas. En un hipotético ciclo estral de 23 días, las
vaquillonas de 2 ondas tendrían 13 días con un folículo en condicionesóptimas de ovulación (≥ 10 mm y en fase de crecimiento), en cambio
las vaquillonas de 3 ondas tendrían 11 días, lo cual se traduciría en
hasta un 10% de diferencia en respuesta ovulatoria a favor de un animal
con 2 ondas foliculares, lo cual es mucho menor a la diferencia
reportada entre vacas y vaquillonas (Tabla 1).
Como ha sido mencionado anteriormente, el momento del ciclo estral
al inicio de un tratamiento basado en GnRH y PGF afecta el porcentaje
de ovulación a la primera GnRH y reduce la tasa de preñez a la
IATF. Por este motivo, una serie de modificaciones se han desarrollado
para mejorar la eficacia de los protocolos de estos protocolos tanto en
vaquillonas como en vacas. Para una revisión más detallada leer los
artículos de Colazo y Mapletoft (6) y Sanz et al. (7). Una de esas modificaciones
es el uso de una presincronización previa al inicio de un protocolo
basado en GnRH. La presincronización realizada mediante la
administración de dos dosis de PGF, o una combinación de GnRH y PGF
o progestágeno y PGF, ha resultado en una mayor respuesta ovulatoria
a la GnRH inicial y una mejor tasa de preñez y son usadas de rutina en
el manejo reproductivo del ganado lechero. Brevemente, la presincronización
mejora la respuesta ovulatoria a la GnRH porque optimiza el
tamaño folicular al momento del tratamiento, sin embargo, la mejor
tasa de preñez no es solamente por una mayor respuesta ovulatoria
pero también porque el nuevo folículo dominante crece bajo una concentración
optima de progesterona. Por último, la ciclicidad podría afectar la respuesta ovulatoria a
la administración de GnRH. En nuestros trabajos con vacas Holstein
(Tabla 1), la respuesta ovulatoria fue mayor en animales que no estaban
ciclando. Esta observación no es del todo sorprendente, ya que
las vacas Holstein que no están ciclando después del periodo de espera
voluntaria en sistemas de producción en Canadá, tienen, en su
mayoría, folículos por encima de los 10 mm de diámetro y, sin el efecto
inhibitorio de la progesterona sobre la liberación de LH. Esto no sería
el caso en animales que no estén ciclando debido a un estrés nutricional
con un estado corporal bajo como puede ocurrir en el ganado de
carne o leche en sistemas de producción bajo sistema de pastoreo. Por
lo tanto, nuestra observación no puede ser extrapolada al ganado bajo
otro sistema de manejo.
Actualmente, hay muchos agonistas de la GnRH disponibles comercialmente en el mercado veterinario (Tabla 2). Las gonadorelinas y fertilinas son decapeptidos sintéticos con una estructura idéntica a la GnRH natural y las buserelinas y lecirelinas son nonapeptidos con una estructura similar a la GnRH, pero con una mayor afinidad, potencia y prolongada acción.
Tabla 2. Lista de agonistas de la GnRH disponibles comercialmente en el mercado
veterinario1.
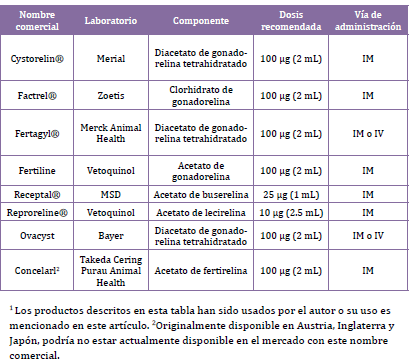
En el ganado vacuno, la dosis recomendada de Fertagyl, Fertiline, Receptal o Reproline no tiene retiro de leche o carne. Sin embargo, el uso de Cystorelin o Factrel requiere un retiro de carne de 7 días.
Muchos estudios han comparado diferentes productos comerciales
de GnRH disponibles en el mercado veterinario.
Uno de los primeros estudios fue el realizado por Chenault et al.
(10) donde se compararon perfiles de LH y FSH después de la administración
de varias dosis de los análogos acetato de fertirelina (25, 50,
100 y 200 μg), diacetato de gonadorelina tetrahidratado (100, 250 y
500 μg), o acetato de buserelina (10 y 20 μg) en vaquillonas Holstein
entre el día 8 y 16 del ciclo estral. Las concentraciones séricas de LH y
FSH aumentaron dentro 15 min después de la inyección de fertirelina
y permaneció elevado por encima de la concentración basal durante
aproximadamente 3 a 6 horas, dependiendo de la dosis. Las concentraciones
de LH aumentaron con cada aumento de la dosis de fertirelina,
de 25 a 100 μg; sin embargo, no hubo un aumento significativo
entre 100 y 200 μg. A medida que se aumentó la dosis de fertirelina,
se aumentó el intervalo entre el tratamiento y el pico de LH, indicando
que la liberación de LH se estimuló por un periodo de tiempo más
prolongado después de la administración de dosis más altas de fertirelina.
Dosis de 50 μg o más de fertirelina y ambas dosis de buserelina
(10 y 20 μg) resultaron en mayor liberación de LH que 100 y 250 μg
de gonadorelina. Sin embargo, la liberación de LH después de la administración
de 500 μg de gonadorelina fue similar a 100 o 200 μg d
fertirelin. En cuanto al tratamiento con 10 μg de buserelina, resultó en
mayor libración de LH que 25, 50 μg de fertirelin o cualquier dosis de
gonadorelina. Basado en la liberación de LH, los autores concluyeron
que acetato de fertirelin es aproximadamente 4 veces más potente que
diacetato de gonadorelina tetrahidratado y que acetato de buserelina
es 10 veces más potente que fertirelina y 50 veces más potente que
gonadorelina.
Otro estudio más reciente de la Universidad de Toulouse en Francia
(32) tuvo como objetivo comparar los perfiles plasmáticos de LH y progesterona
y la dinámica folicular en respuesta a la administración de
las dosis recomendadas de Cystorelin (diacetato de gonadorelina tetrahidratado),
Reproreline (acetato de lecirelina) o Receptal (acetato
de buserelina). También se evaluó la respuesta biológica a media dosis
de lecirelina. En un diseño de cuadrado latino, se utilizaron vacas
Holstein (n = 12) que recibieron los siguientes tratamientos: 1) 100 μg
de gondorelina, 2) 25 μg de lecirelina, 3) 50 μg de lecirelina, o 4) 10μg de buserelina en el día 6 o 7 del ciclo estral. Se tomaron muestras
de sangre regularmente hasta 4 días después de la administración de
GnRH. La respuesta de LH en plasma se evaluó hasta 6 horas después del tratamiento, y la respuesta de progesterona plasmática y la dinámica
folicular ovárica fueron evaluados por 4 días. Hubo una liberación
de LH significativamente más baja después de la administración
de gonadorelina en comparación con los otros 3 tratamientos. La concentración
media máxima de LH después del tratamiento con gonadorelina
se alcanzó 1 hora antes y fue 2.5 veces menor que el tratamiento
con lecirelina (25 o 50 μg) o buserelina. Cuatro días después de la administración
de GnRH (es decir, en los días 10 y 11 del ciclo estral), el
aumento promedio en la concentración de progesterona en plasma fue
del 70% y no difirió entre los tratamientos. El porcentaje de ovulación
fue 73%, 82%, 100% y 100%, para 100 μg de gonadorelina, 25 μg de
lecirelina, 50 μg de lecirelina y 10 μg de buserelina, respectivamente.
Por lo tanto, estos resultados sugerirían que lecirelina y buserelina inducen
una mayor liberación de LH que gonadorelina y que el doble de
la dosis recomendada de lecirelina (50 μg) es necesaria para obtener
la misma repuesta ovulatoria que la recomendada dosis de buserelina
(10 μg).
Otros autores compararon diferentes gonadorelinas disponibles en
el mercado veterinario en Norte América. Un estudio de la Universidad
de Saskatchewan (11) tuvo como objetivo evaluar la secreción de LH y
la dinámica folicular en vacas y vaquillonas después de la administración
de 3 formulaciones de gonadorelina que estaban comercialmente
disponible en Canadá. En el experimento 1, vacas Holstein no lactantes
(n = 4 por grupo) fueron aleatoriamente asignadas para recibir 100μg de diacetato de gonadorelina tetrahidratado, por vía intramuscular
(Cystorelin o Fertagyl) al azar del ciclo estral. Se tomaron muestras
de sangre para determinar la concentración de LH a las 0, 1, 2 y
4 horas después del tratamiento. En el experimento 2, se utilizaron
vacas Holstein no lactantes (n = 10 por grupo) que recibieron 100 μg
de gonadorelina de la siguiente manera: 2 mL de Cystorelin; 1 ml de
Fertagyl; o 2 mL de Factrel (clorhidrato de gonadorelina). El tratamiento
se realizó los días 6 o 7 del ciclo estral y la determinación de
LH se realizó a las 0, 1, 2, 4 y 6 horas después del tratamiento. Se examinaron
los ovarios mediante ultrasonografía, dos veces al día, para
detectar la ovulación. En el experimento 3, vaquillonas de carne (n =
10 por grupo) fueron asignadas al azar para recibir 1 de las 3 gonadorelinas
(Cystorelin, Fertagyl o Factrel) a los 6 o 7 del ciclo estral y se
tomaron muestras de sangre a las 0, 0.5, 1, 1.5, 2 y 4 horas después del
tratamiento. En el experimento 1, las concentraciones plasmáticas de
LH aumentaron significativamente por 1 o 2 h y disminuyó a los niveles
basales a las 4 h después del tratamiento con GnRH. La concentración
media de LH tendió a ser mayor en el grupo Cystorelin que en que
en el grupo Fertagyl. En los experimentos 2 y 3, las concentraciones plasmáticas medias y máximas de LH fueron más altas en el ganado
tratado con Cystorelin. La proporción de folículos dominantes que
ovularon fue mayor en vacas Holstein tratadas con Cystorelin que en
aquellas tratadas con Fertagyl o Factrel (95%, 58% y 57%, respectivamente),
pero no hubo diferencia significativa entre las gonadorelinas
en vaquillonas de carne (60%, 60% y 40%, respectivamente). No se
encontraron diferencias significativas entre gonadorelinas para el intervalo
desde el tratamiento hasta la aparición de la siguiente onda
folicular. En resumen, Cystorelin indujo una mayor liberación de LH y
esto resultó en una mayor tasa de ovulación en vacas Holstein, pero no
en vaquillonas de carne.
Souza et al. (33) evaluó cuatro productos de gonadorelina disponibles
comercialmente en los Estados Unidos. En este estudio se determinó la respuesta al tratamiento con GnRH en vacas lecheras 7 días
después del último tratamiento con GnRH de un protocolo Ovsynch.
Las vacas seleccionadas (con un cuerpo lúteo (CL) ≥15 mm y al menos
un folículo ≥10 mm) se dividieron al azar para recibir una dosis de
100 μg de: (1) Cystorelin (n = 146); (2) Factrel (n = 132); (3) Fertagyl
(n = 140); o (4) Ovacyst (diacetato de gonadorelina tetrahidratado, n
= 140). Siete días después del tratamiento, se determinó la ovulación
mediante la detección de un CL accesorio a través de ultrasonografía.
Las concentraciones circulantes de LH también se evaluaron en algunas
vacas después del tratamiento con 100 μg (n = 10 por grupo) o
50 μg (n = 5 por grupo) de GnRH. El porcentaje de vacas que ovularon
difirió entre las gonadorelinas, siendo más bajo el de Factrel (55%)
comparado con Cystorelin (77%), Fertagyl (74%) u Ovacyst (85%). No
hubo efecto del lote, la paridad o el tamaño del folículo en la respuesta
ovulatoria, pero el aumento de la condición corporal disminuyó la
respuesta ovulatoria. Hubo una liberación de LH mucho mayor en las
vacas tratadas con 100 μg que en las tratadas con 50 μg, pero no hubo
diferencias detectables entre gonadorelinas sobre el perfil de LH circulante
después del tratamiento. Por lo tanto, este estudio sugiere que
la repuesta ovulatoria a la administración de Factrel es menor que la
de Cystorelin, Fertagyl u Ovacyst, aunque no se demostró un mecanismo
que explique esa diferencia entre productos.
Las gonadorelinas son los agonistas de GnRH más comúnmente usados
en el ganado bovino en Norte América y la dosis recomendada es de
100 μg independientemente de la sal utilizada (Tabla 1). Sin embargo,
varios autores han comparado diferente dosis de gonadorelinas en el ganado vacuno y los resultados de esos estudios sugerirían que la dosisóptima de gonadorelina es quizás superior a la dosis recomendada.
En el trabajo de Chenault et al. (10) descrito anteriormente, la administración
de 100, 200 o 500 μg de diacetato de gonadorelina tetrahidratada
(Cystorelin), en vaquillonas Holstein en diestro, resulto enáreas debajo de la curva de LH de 328, 535 y 1805, respectivamente.
Los picos de LH sérica fueron 2.5, 4.6 y 13.1 para 100, 200 o 500 μg de
diacetato de gonadorelina tetrahidratada.
Nuestro grupo de trabajo comparó (34) las concentraciones plasmáticas
de LH en vacas ovariectomizadas tratadas con 50, 100 o 250μg de acetato de gonadorelina (Fertiline). Fue muy evidente que una
dosis de 250 μg de GnRH aumentó la concentración de LH plasmática
en comparación con 50 y 100 μg, pero no se observó ninguna diferencia
significativa entre los niveles plasmáticos de LH entre vacas
que recibieron 50 o 100 μg de GnRH. En concordancia con nuestros
resultados, una dosis de 50 μg de GnRH diacetato de gonadorelina tetrahidratada
fue tan eficaz como 100 μg cuando se utilizaron en un
protocolo Ovsynch en vacas lecheras en lactación (35), con una tasa de
preñez global a la IATF del 41%. Sin embargo, Souza et al. (33) observo
una mayor liberación de LH en vacas tratadas con 100 que con 50 μg.
En el trabajo de Dias et al. (17), que ya ha sido descrito más detalladamente,
las concentraciones de LH en plasma (14.8 ± 2.1 vs. 9.8 ± 1.4
ng/mL) y el porcentaje de ovulación (76% vs. 56%) fueron más altos
en vaquillonas que recibieron 200 vs. 100 μg de diacetato de gonadorelina
tetrahidratada (Cystorelin). Mas recientemente, Giordano et al.
(36) reportó que vacas lecheras que recibieron 200 μg de diacetato de
gonadorelina tetrahidratado (Fertagyl) tuvieron un pico de LH y unárea debajo de la curva mayor que vacas que recibieron 100 μg, independientemente
de los niveles plasmáticos de progesterona al momento
del tratamiento.
En conformidad con los resultados descritos anteriormente, Mihm et
al. (37) informaron que 250 μg de diacetato de gonadorelina tetrahidratada
fue más eficaz que 100 μg en inducir la ovulación en vaquillonas de carne
tratadas durante el diestro. Sin embargo, la inclusión de dosis altas de
GnRH en un protocolo de IATF no se ha investigado en vaquillonas.
Por lo tanto, sería de esperar que una dosis de gonadorelina superior
a la recomendada de 100 μg sería más beneficiosa especialmente
cuando la GnRH se administra durante el diestro y en vaquillonas que
tienen una menor respuesta ovulatoria que las vacas.
Alta concentraciones de progesterona reducen tanto la liberación
de LH como la respuesta ovulatoria, sin embargo, la concentración de
estrógeno en sangre tiene un efecto positivo sobre la liberación de LH.
Por lo tanto, una mayor tasa de ovulación después de la administración
de GnRH podría incrementarse minimizando las concentraciones
de progesterona circulante y aumentando las concentraciones de estrógeno
en el momento del tratamiento.
La presincronización aumenta el porcentaje de ovulación a la GnRH
inicial y mejora la tasa de preñez, consecuentemente, esta estrategia
es de uso rutinario en vacas Holstein lactantes. Sin embargo, la tasa de
ovulación es por lo general más baja en vaquillonas que en vacas, pero
no se confirmó la hipótesis de que las vaquillonas eran más sensibles
que las vacas a los efectos supresores de la progesterona. Por lo tanto,
es necesario desarrollar nuevas estrategias con el objetivo de optimizar
los programas de IATF en vaquillonas
Los nonapéptidos tienen una mayor afinidad, potencia y acción prolongada
que los decapéptidos sintéticos con una estructura idéntica a
la GnRH natural. En aquellos mercados veterinarios en los cuales los
nonapéptidos estén disponibles, su utilización sería el recomendado.
Dosis más altas de gonadorelina, que las recomendadas, inducen una
mayor liberación de LH y podrían resultar en una mayor tasa de ovulación
independientemente de la concentración circulante de esteroides.
Los autores agradecen a estudiantes, productores y empresas farmacéuticas que colaboraron con los trabajos de investigación mencionados en este artículo. Los autores también expresan un sincero agradecimiento al Dr. Marcelo Ratto (Universidad Austral de Chile) por la revisión científica del artículo.
1. Kittok RJ, Britt JH, Convey EM. Endocrine response after GnRH in luteal phase cows and cows with ovarian follicular cysts. J Anim Sci 1973; 37:985–989.
2. Schams D, Hofer F, Hoffmann B, Ender M, Karg H. Effects of synthetic LH-RH treatment on bovine ovatian function during oestrous cycle and postpartum period. Acta Endocrinologica Suppl 1973: 177:296 (Abstr.).
3. Britt JH, Kittok RJ, Harrison DS. Ovulation, estrus and endocrine response after GnRH in early postpartum cows.J Anim Sci 1974; 39:915-919.
4. Twagiramungu H, Guilbault LA, Dufour JJ. Synchronization of ovarian follicular waves with a gonadotropin-releasing hormone agonist to increase the precision of estrus in cattle: A review. J Anim Sci 1995; 73:3141-3151.
5. Martínez MF, Adams GP, Bergfelt D, Kastelic JP, Mapletoft RJ. Effect of LH or GnRH on the dominant Follicle of the first follicular wave in heifers.Anim Reprod Sci 1999; 57:23-33.
6. Colazo MG and Mapletoft RJ. A review of current timed-AI (TAI) programs for beef and dairy cattle. Can Vet J 2014; 55:772-780.
7. Sanz A, Macmillan K, Colazo MG. Revisión de los programas de sincronización ovárica basados en el uso de hormona liberadora de gonadotropinas y prostaglandina F2α para novillas de leche y de carne. ITEA-Inf. Tec. Econ. Agrar. 2019; 115: 326-341.
8. Perrett RM and McArdle CA. Molecular mechanisms of gonadotropin-releasing hormone signaling: integrating cyclic nucleotides into the network. Front. Endocrinol 2013; 4:180. doi: 10.3389/fendo.2013.00180.
9. Kaltenbach CC, Dunn TG, Kiser TE, Corach LR, Akbar AM, Niswender GD. Release of FSH and LH in beef heifers by synthetic gonadotrophin releasing hormone. J Anim Sci 1974; 38:357-362.
10. Chenault JR, Kratzer DD, Rzepkowski RA, Goodwin MC. LH and FSH response of Holstein heifers to fertirelin acetate, gonadorelin and buserelin. Theriogenology 1990; 34: 81–98.
11. Martínez M, Mapletoft RJ, Kastelic JP, Carruthers T. The effects of 3 gonadorelin products on luteinizing hormone release, ovulation, and follicular wave emergence in cattle. Can Vet J 2003; 44:125-131.
12. Macmillan KL and Thatcher WW. Effects of an agonist of gonadotropin-releasing hormone on ovarian follicles in cattle. Biol Reprod 1991; 45:883-889.
13. Kesler D J; Elmore R G; Brown E M; Garverick H A. Gonadotropin releasing hormone treatment of dairy cows with ovarian cysts. I. Gross ovarian morphology and endocrinology Theriogenology 1981;16: 207-217.
14. Moreira F, de la Sota RL, Diaz T, Thatcher WW. Effect of day of the estrous cycle at the initiation of a timed artificial insemination protocol on reproductive responses in dairy heifers. J Anim Sci 2000; 78:1568-1576.
15. Di Gregorio GB and Nett TM. Estradiol and progesterone influence the synthesis of gonadotropins in the absence of gonadotropin-releasing hormone in the ewe. Biol Reprod 1995; 53:166-172.
16. Colazo MG, Davis H, Rutledge MD, Kastelic JP, Martinez MF, Small JA, Mapletoft RJ. Effects of plasma progestwerone concentrations on LH release and ovulation in beef cattle given GnRH. Domest Anim Endocrinol 2008; 34:109-117.
17. Dias FCF, Colazo MG, Kastelic JP, Mapletoft RJ, Adams GP, Singh J. Progesterone concentration, estradiol pre-treatment, and dose of GnRH affect GnRH-mediated LH release in beef heifers. Domest Anim Endocrinol 2010; 39:155-162.
18. Xu ZZ, Garverick HA, Smith GW, Smith MF, Hamilton SA, Youngquist RS. Expression of follicle-stimulating hormone and luteinizing hormone receptor messenger ribonucleic acids in bovine follicles during the first follicular wave. Biol Reprod 1995; 53:951-957.21.
19. Pursley JR, Mee MO, Wiltbank MC. Synchronization of ovulation in dairy cows using PGF2α and GnRH. Theriogenology 1995; 44:915-923.
20. Schoenemann HM, Humphrey WD, Crowder ME, Nett TM, Reeves JJ. Pituitary luteinizing- hormone-releasing hormone receptors in ovariectomized cows after challenge with ovarian-steroids. Biol Reprod 1985; 32:574–583.
21. Nett TM, Turzillo AM, Baratta M, Rispoli LA. Pituitary effects of steroid hormones on secretion of follicle-stimulating hormone and luteinizing hormone. Domest Anim Endocrinol 2002; 23:33–42.
22. Baratta M, West LA, Turzillo AM, Nett TM. Activin modulates differential effects of estradiol on synthesis and secretion of follicle-stimulating hormone in ovine pituitary cells. Biol Reprod 2001; 64:714–719.
23. Small JA, Colazo MG, Kastelic JP, Mapletoft RJ. Effects of progesterone presynchronization and eCG on pregnancy rates to GnRH-based, timed-AI in beef cattle. Theriogenology 2009; 71:698-706.
24. Colazo MG, Gordon MB, Rajamahendran R, Mapletoft RJ, Ambrose DJ. Pregnancy rates to timed-AI in dairy cows treated with gonadotropin releasing hormone or porcine luteinizing hormone. Theriogenology 2009a; 72:262-270.
25. Colazo MG, Ambrose DJ. Neither duration of progesterone insert nor initial GnRH treatment affect pregnancy per timed-insemination in dairy heifers subjected to a Co-synch protocol. Theriogenology 2011; 76:578-588.
26. Colazo MG, Ponce-Barajas P, Ambrose DJ. Pregnancy per AI in lactating dairy cows subjected to two different intervals from presynchronization to initiation of Ovsynch protocol. J Dairy Sci 2013a; 96:7640-7648.
27. Colazo MG, Dourey A, Rajamahendran R, Ambrose DJ. Progesterone supplementation before timed AI increased ovulation synchrony and pregnancy per AI, and supplementation after timed AI reduced pregnancy losses in lactating dairy cows. Theriogenology 2013b; 79:833-841.
28. Dirandeh E, Rezaei Roodbari A, Gholizadeh M, Deldar H, Masoumi R, Kazemifard M, Colazo MG. Administration of prostaglandin F2α 14 d before initiating a G6G or a G7G timed artificial insemination protocol increased circulating progesterone prior to artificial insemination and reduced pregnancy loss in multiparous Holstein cows. J Dairy Sci 2015a; 98:5414-5421.
29. Dirandeh E, Rezaei Roodbari A, Colazo MG. Double-Ovsynch, compared to Presynch with or without GnRH, improves fertility in heat-stressed lactating dairy cows. Theriogenology 2015b; 83:438-443.6.
30. Colazo MG and Ambrose DJ. Effect of initial GnRH and duration of progesterone insert treatment on the fertility of lactating dairy cows. Reproduction Domestic Animal 2015; 50:497-504.
31. Zwiefelhofer EM, Macmillan K, Gobikrushanth M, Adams GP, Yang SX, Anzar M, Asai-Coakwell M, Colazo MG. Comparison of two intravaginal progesterone-releasing devices in shortened-timed artificial insemination protocols in beef cattle. Theriogenology 2021; 168: 75-82.
32. Picard-Hagen N, Lhermie G, Florentin S, Merle D, Freina P, Gayrard V. Effect of gonadorelin, lecirelin, and buserelin on LH surge, ovulation, and progesterone in cattle. Theriogenology 2015; 84:177–183.
33. Souza AH, Cunha AP, Silva EPB, Gumen A, Ayres H, Guenther JN, Wiltbank MC. Comparison of gonadorelin products in lactating dairy cows: Efficacy based on induction of ovulation of an accessory follicle and circulating luteinizing hormone profiles. Theriogenology 2009; 72:271–279.
34. Colazo MG, Ree T, Emmanuel DGV, Ambrose DJ. Plasma luteinizing hormone concentrations and luteal function in cows given repeated treatments or various doses of gonadotropin releasing hormone. Theriogenology 2009b; 71:984-992.
35. Fricke PM, Guenther JN, Wiltbank MC. Efficacy of decreasing the dose of GnRH used in a protocol for synchronization of ovulation and timed AI in lactating dairy cows. Theriogenology 1998; 50:1275–1284.
36. Giordano JO, Fricke PM, Guenther JN, Lopes Jr G, Herlihy MM, Nascimento AB, Wiltbank MC. Effect of progesterone on magnitude of the luteinizing hormone surge induced by two different doses of gonadotropin-releasing hormone in lactating dairy cows. J. Dairy Sci 2012; 95:3781–3793.
37. Mihm M, Delatang F, Roche JF. The gonadotrophin and ovarian responses to an intermediate or low dose of gonadorelin in beef heifers: influence of dose, follicle status and progesterone environment. J Reprod Fertil 1998; 21: 74 (Abstr.).
Fecha de recepción del artículo: 23/06/2022
Fecha de aprobado para su publicación: 08/08/2022