DOI:http://dx.doi.org/10.19137/cienvet202224201
![]() Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
ARTICULO DE INVESTIGACIÓN
Efectos del estado fenológico, del marchitado
y de la aplicación de un inoculante microbiano
sobre la calidad nutricional de ensilaje de alfalfa
Effects of phenological stage, wilting and
microbial inoculant application on nutritional
quality of alfalfa silage
Efeitos do estado fenológico, murcha e aplicação
de inoculante microbiano na qualidade
nutricional da silagem de alfafa
Genero GA, Pechin GH, Sánchez LO, Ginart LA, Denda SS, Sánchez C,
Godoy TA, Gerena A
Facultad de Ciencias Veterinarias, Universidad Nacional de La Pampa, calle 5 esquina 116, General Pico
(6360), La Pampa.
Correo electrónico: generog@vet.unlpam.edu.ar
RESUMEN: El objetivo de este trabajo fue evaluar los efectos del estado fenológico,
del marchitado y de la aplicación de un inoculante microbiano
sobre la composición química, la concentración de ácidos orgánicos
y la degradabilidad ruminal de la materia seca (DRMS) en ensilaje de
alfalfa. La pastura fue cortada en dos estados fenológicos: 10 % (F10)
y 50 % (F50) de floración y el material fue dividido en dos fracciones:
con marchitado (CM) y sin marchitado (SM). Cada fracción fue picada
y asperjada con un inoculante (Lactobacillus plantarum, 5×109 células viables/g, CI) o con agua destilada (sin inoculante, SI) y ensilada en microsilos
de PVC, con 6 repeticiones por tratamiento. Al cabo de 90 días
se determinaron: pH, contenido de materia seca (MS), proteína bruta
(PB), nitrógeno amoniacal (N-NH3), fibra detergente neutra (FDN) yácida (FDA), DRMS a tiempo fijo (30 h), ácidos acético (C2), propiónico
(C3), butírico (C4) y láctico (AL). El marchitado disminuyó el pH,
el contenido de N-NH3, FDN y FDA, e incrementó la concentración de
PB del ensilaje. En F10, el marchitado disminuyó la concentración de
C2, C3 y C4, y aumentó la de AL. En F50, el marchitado disminuyó la
concentración de C2 en los dos niveles de inoculante y, solo cuando el
inoculante no fue aplicado, el marchitado disminuyó la de C3 y C4, y
aumentó la de AL. En F50-SM, la aplicación de inoculante disminuyó el
contenido de C2, C3 y C4, y aumentó la de AL. La DRMS fue más alta en
CM que en SM, y fue mayor en F10 vs. F50 solamente cuando se aplicó marchitado. La aplicación del inoculante disminuyó el contenido de
FDN y, en F50, bajó el nivel N-NH3. Puede concluirse que el uso del
marchitado mejora la calidad nutricional del ensilaje de alfalfa, mientras
que el efecto de L. plantarum se limita a algunas combinaciones
de tratamientos.
Palabras clave: Ensilaje de alfalfa, Lactobacillus plantarum, Estado
fenológico, Marchitado
ABSTRACT:
The objective of this work was to assess the effects of phenological
stage, wilting and a microbial inoculant on chemical composition,
organic acids concentration and ruminal degradability of dry matter
(DMRD) of alfalfa silage. The pasture was cut in two phenological
stages: 10 % (F10) and 50 % (F50) of flowering, and the material
was divided into two fractions: with wilting (W) and without wilting
(NW). Each fraction was chopped and sprayed with an inoculant
(Lactobacillus plantarum, 5 × 109 viable cells/g, I) or with distilled water
(no inoculant, NI) and ensiled in PVC microsilos, with 6 replications
per treatment. After 90 days, pH, dry matter (DM), crude protein (CP),
ammonia nitrogen (NH3-N), neutral detergent fiber (NDF) and acid
detergent fiber (ADF), DMRD at 30 h, acetic (C2), propionic (C3), butyric
(C4) and lactic (LA) acids were determined. The wilting process
decreased pH, NH3-N, NDF and ADF, and increased CP of the silage.
In F10, wilting decreased the concentration of C2, C3 and C4, and increased
LA. In F50, wilting decreased the C2 concentration at the two
levels of inoculant, and only when inoculant was not applied, wilting
decreased C3 and C4, and increased LA. In F50-NW the application of inoculant decreased the content of C2, C3 and C4, and increased LA.
The DMRD of W was higher than NW, and it was higher in F10 vs F50
only when wilting was applied. The inoculant application decreased
the NDF content, and in F50 it decreased NH3-N level. It can be concluded
that the use of wilting improves the nutritional quality of alfalfa
silage, while the effect of L. plantarum is limited to some combinations
of treatments.
Key words: Alfalfa silage, Lactobacillus plantarum, Phenological
stage, Wilting
RESUMO: Objetivo deste trabalho foi avaliar os efeitos do estádio fenológico,
murchamento e aplicação de inoculante microbiano sobre a composição
química, a concentração de ácidos orgânicos e a degradabilidade ruminal
da matéria seca (DMR) em silagem de alfafa. A pastagem foi cortada
em dois estádios fenológicos: 10 % (F10) e 50 % (F50) de floração e o
material foi dividido em duas frações: murcha (CM) e sem murcha (SM).
Cada fração foi triturada e polvilhada com um inoculante (Lactobacillus
plantarum, 5×109 células viáveis/g, CI) ou com água destilada (sem
inoculante, SI) e ensilada em microsilos de PVC, com 6 repetições por
tratamento. Após 90 dias, foram determinados: pH, teor de matéria seca
(MS), proteína bruta (PB), nitrogênio amoniacal (N-NH3), fibra em detergente
neutro (FDN) e fibra em detergente ácido (FDA), DRMS em um
tempo fixo (30 h), ácidos acético (C2), propiônico (C3), butírico (C4) e
lático (AL). A murcha diminuiu o pH, o teor de N-NH3, FDN e FDA, e aumentou
a concentração de PB da silagem. Em F10, a murcha diminuiu
a concentração de C2, C3 e C4 e aumentou a de AL. Em F50, a murcha
diminuiu a concentração de C2 nos dois níveis de inoculante e, somente
quando o inoculante não foi aplicado, a murcha diminuiu a de C3 e C4
e aumentou a de AL. Em F50-SM, a aplicação do inoculante diminuiu o
teor de C2, C3 e C4, e aumentou o de AL. DRMS foi maior em CM do que
em SM, e foi maior em F10 vs. F50 somente quando aplicado murcho.
A aplicação do inoculante diminuiu o teor de FDN e, em F50, o teor de
N-NH3 diminuiu. Pode-se concluir que o uso da murcha melhora a qualidade
nutricional da silagem de alfafa, enquanto o efeito de L. plantarum plantarumé limitado a algumas combinações de tratamentos.
Palavras-chave: Silagem de alfafa, Lactobacillus plantarum, Estágio
fenológico, Murcha
El uso de la alfalfa para la confección de reservas forrajeras juega
un rol importante en los planteos de producción bovina de carne y
leche, permitiendo no sólo estabilizar la oferta forrajera, sino también
ajustar las dietas en cuanto a su contenido de fibra efectiva y proteína.
Aunque la forma de reserva más común de la alfalfa es el heno, los
análisis de composición química muestran deficiencias en calidad nutricional:
16 % de proteína bruta (PB), con mínimo de 13 y máximo de
24 %, 56 % de fibra detergente neutro (FDN), 44 % de fibra detergente ácido (FDA) y 58 % de digestibilidad de la materia seca, en parte explicadas
por el uso de maquinaria de corte inapropiada, un inadecuado
manejo de los lotes y el almacenamiento de los rollos a la intemperie (1). Una alternativa de conservación y almacenamiento que puede
mejorar el valor nutricional de las reservas de alfalfa es la confección
de ensilajes. Sin embargo, este cultivo tiene una baja concentración
de azúcares y un alto contenido de proteína que limitan una rápida
fermentación y acidificación del material ensilado. La baja concentración
de azúcares condiciona el crecimiento bacteriano, mientras que el
elevado contenido proteico cumple la función de buffer(2).
Durante la fermentación del forraje, la tasa y magnitud de disminución
del pH determina el grado de pérdida de nutrientes del ensilaje.
Esta pérdida de calidad es debida a la acción de enzimas de la planta
y de microbios anaerobios. El uso de aditivos biológicos y químicos
puede promover patrones de fermentación adecuados, especialmente
cuando existen condiciones subóptimas, como puede ser el caso del
ensilado de alfalfa. Dentro de los aditivos biológicos, se encuentran
los inoculantes microbianos y las enzimas(3). Entre los inoculantes microbianos
usados más frecuentemente están los que contienen bacterias ácido lácticas (BAL) homofermentativas (Ho). Actualmente, la
mayoría de las bacterias de este grupo se clasifican taxonómicamente
como heterofermentativas facultativas (HeF) en lugar de Ho obligadas( 4). Ambos grupos fermentan las hexosas y producen ácido láctico
(AL) pero, además, las BAL HeF poseen la enzima fosfocetolasa que
les permite fermentar pentosas hasta AL y ácido acético (C2). Otro
grupo lo constituyen las heterofermentativas obligadas (por ejemplo,
Lactobacillus buchneri) que producen otros compuestos, además de
AL(5). La inoculación de ensilajes con BALHo y BALHeF ha demostrado
ser efectiva para mejorar los parámetros de fermentación a través
del incremento de AL y de la reducción del pH, de la concentración de ácido butírico (C4) y de nitrógeno amoniacal (N-NH3). Por otro lado,
también se verificó una inhibición del crecimiento de microbios epífitos
deletéreos, como clostridios y hongos. Algunas de estas especies de BAL son L. plantarum, L. faecium, Enterococcus faecium y varias especies
del género Pediococcus(6).
Otro factor que dificulta una adecuada fermentación láctica en el
cultivo de alfalfa es el alto contenido de agua en el momento óptimo
de calidad nutricional del forraje. En general, el contenido de materia
seca (MS) en la planta de alfalfa se encuentra entre 18,3 ± 6,2 % y 22,4± 6,5 % para alfalfas en pre-floración y mediados de floración, respectivamente(7). Si el forraje es ensilado con un alto contenido de humedad,
el establecimiento de las BAL se ve alterado y la disminución del
pH no es suficiente como para inhibir el crecimiento de clostridios, los
cuales se multiplican y fermentan el AL a butírico y a los aminoácidos
a amonio, resultando en incrementos del pH y pérdidas de MS(3,8).
Una herramienta para reducir el contenido de humedad del cultivo a
ensilar, favorecer la fermentación y disminuir las pérdidas de MS es
realizar el marchitado u oreo previo al picado(2,9). Sin embargo, un
marchitado de mayor magnitud predispone a una fermentación más
lenta y con menores valores finales de AL, debido a que el crecimiento
bacteriano se reduce cuando la concentración de agua es baja(10). Los
ensilajes confeccionados con forrajes marchitados suelen presentar
un mayor pH o una disminución más lenta de este, un mayor nivel de
carbohidratos solubles en agua (CSA), y un menor contenido de AL, C2
y N-NH3
(10,9).
Por otro lado, se han observado interacciones entre el uso de marchitado
y la aplicación de inoculantes microbianos sobre algunos parámetros
de fermentación y la degradabilidad de la MS(9), lo cual amerita
una mayor investigación.
El objetivo del presente trabajo fue evaluar los efectos del estado
fenológico, de la aplicación de un inoculante microbiano a base de L
plantarum y del marchitado sobre la composición química, la concentración
de ácidos orgánicos y la degradabilidad ruminal de la MS
(DRMS) en ensilaje de alfalfa.
Se trabajó con la variedad de alfalfa Don Gaspar 15-601 (Brandemann
y Cía. S.C.), grupo 6, implantada en un campo ganadero a 35 km al suroeste
de General Pico, La Pampa. El forraje fue cortado mediante motoguadaña,
en diciembre de 2015, en dos estados fenológicos: 10 %
(F10) y 50 % (F50) de floración. El material correspondiente a cada
estado fenológico fue dividido en dos fracciones: con marchitado (CM)
y sin marchitado (SM). La fracción SM fue picada inmediatamente
posterior al corte con una minipicadora de forraje para la confección
de los microsilos. En la fracción CM, el marchitado se llevó a cabo en el mismo lugar de corte, sobre el suelo y en condiciones naturales. El
contenido de MS del forraje CM fue monitoreado cada una hora por la
metodología de microondas, según Petruzzi et al.(11), hasta alcanzar el
valor deseado de 45 %. Una vez alcanzado este porcentaje de MS, el
material fue procesado de igual manera que SM. Para la confección de
los microsilos se procedió de la siguiente manera: de cada porción del
material de F10-SM, F10-CM, F50-SM y F50-CM, se tomaron 12 fracciones
de 2,4 kg de peso húmedo, 6 de las cuales fueron asperjadas
con 30 ml de una solución de inoculante biológico (con inoculante, CI)
y 6 con el mismo volumen de agua destilada (sin inoculante, SI). El
inoculante estuvo compuesto por cultivos de L. plantarum (5×109 células
viables/g) y para la dosificación se siguieron las indicaciones del
fabricante (100 g de inoculante cada 50 toneladas de peso húmedo de
forraje). Cada una de las porciones de 2,4 kg de forraje fue ensilada en
microsilos de PVC, de 11 cm de diámetro y 50 cm de largo (48 microsilos
en total), equivalente a una densidad de 610 kg/m3.
De esta manera quedaron definidos 8 tratamientos por la combinación
de 3 factores (F: estado fenológico; M: marchitado; I: inoculante),
con 2 niveles cada uno (F: F10 y F50; M: CM y SM; I: CI y SI), en un
diseño completamente aleatorizado con arreglo factorial 2×2×2, con
6 repeticiones.
Los microsilos fueron llevados al Laboratorio de Nutrición Animal
de la Facultad de Ciencias Veterinarias (UNLPam) y conservados a
temperatura ambiente hasta su apertura después del día 90 de su confección,
para la realización de los distintos análisis. Inmediatamente
luego de la apertura, se tomaron dos muestras de 25 g, una para la
medición del pH con un pHmetro digital, y la otra, para la determinación
de ácidos orgánicos. Para la medición de los ácidos orgánicos
se procedió a la obtención de un extracto de la siguiente manera: la
muestra de 25 g se colocó en un recipiente de vidrio y se adicionaron
250 ml de agua destilada, se tapó herméticamente y se mantuvo refrigerada
a 8 °C. Pasadas 24 h, el contenido fue filtrado. De este filtrado
se tomaron 8 ml, se adicionaron 2 ml de HCl 0,2 N y se refrigeró por
24 h más. Por último, se procedió a la centrifugación a 10.000 rpm y
10 °C y se obtuvo 1 ml del sobrenadante, que fue congelado hasta la
determinación de los ácidos orgánicos en el Laboratorio de Nutrición
Animal, Facultad de Agronomía, Universidad de Buenos Aires. La purificación
de las muestras se realizó con ácido meta-fosfórico (25 %
en ácido sulfúrico 0,5 M) a razón de 0,5 ml por cada 2 ml de muestra y
luego fueron centrifugadas por 10 minutos a 10.000 rpm. La determinación
de AGVs y AL se realizó por cromatografía gaseosa con un equipo
Konik-3000 y una columna BP-20 (marca SGE) con N2 como vehículo
y según protocolo recomendado por el fabricante de la columna(12).
La temperatura del inyector y del detector de ionización de llama fue
mantenida a 250 ºC.
Para la determinación de la concentración de N-NH3 se tomó una
muestra de 10 g de ensilaje y se homogeneizó en 600 ml de agua destilada
durante 2 minutos, en licuadora a potencia máxima. El homogeneizado
fue filtrado y el líquido resultante centrifugado a 10.000 g
durante 10 minutos a una temperatura de 4 °C. Sobre el líquido sobrenadante
se determinó la concentración de N-NH3 por medio de la
lectura en un espectrofotómetro, según la técnica de Weatherburn (13).
Por último, una porción representativa de cada microsilo fue congelada
a – 20 °C, hasta la realización de los análisis de MS, PB, FDN,
FDA y DRMS. Con una submuestra de 200 g se determinó MS con estufa
de flujo continuo a 105 ºC. Otra submuestra de 200 g fue secada
a 60 °C y molida en un molino tipo Resch, provisto con una malla de 2
mm de diámetro, la cual fue utilizada para los análisis de PB(14), FDN y
FDA(15) y DRMS.
Para la determinación de la DRMS se pesaron 3,6 g de MS de cada
muestra y se colocaron en bolsas de poliamida de 10 × 20 cm con una
porosidad de 50 μm (Ankom®). Cada bolsa fue cerrada mediante un
precinto plástico para evitar la pérdida de material, quedando una superficie
efectiva de 360 cm2 (10 × 18 × 2) y una relación de 10 mg/
cm2 entre cantidad de muestra y superficie de la bolsa, de acuerdo a
Vanzant et al.(16). Las 48 bolsas correspondientes a cada repetición de
cada tratamiento, más 2 blancos, se colocaron dentro de una bolsa rejilla,
junto con una cadena de 1 kg de peso, para permitir su contacto
con el saco ruminal ventral, y una cuerda de nylon de 60 cm de longitud
para fijarla a la cánula, permitiendo su libre movimiento dentro del
rumen(17). La bolsa rejilla fue introducida en el rumen de una hembra
bovina Hereford, canulada y alimentada con heno de alfalfa. Las bolsas
fueron retiradas a las 30 h pos incubación e inmediatamente lavadas
bajo el flujo de agua, por aproximadamente 90 segundos, hasta que el
agua salió límpida, para frenar la acción microbiana y eliminar restos
de contenido ruminal(18). Luego, se llevaron a estufa a 60 °C hasta peso
constante para determinar la cantidad de MS no degradada y calcular
la DRMS.
Para el análisis estadístico se realizó un ANOVA con un modelo que
consideró los efectos fijos de los 3 factores (F, M, I) y sus interacciones
(F×M, F×I, M×I, F×M×I). Cuando la interacción triple resultó significativa
(p< 0,05), la variable en cuestión fue analizada en dos modelos
independientes separados por el factor “F” que consideró los efectos
M, I y M×I. La estimación y comparación de las medias de los tratamientos
se hizo por el método LSMEANS (least squares means: Medias
de mínimos cuadrados) del procedimiento “PROC GLM” del paquete estadístico SAS 9.1(19). Los efectos de tratamiento y las interacciones
fueron declarados significativos cuando p resultó menor a 0,05.
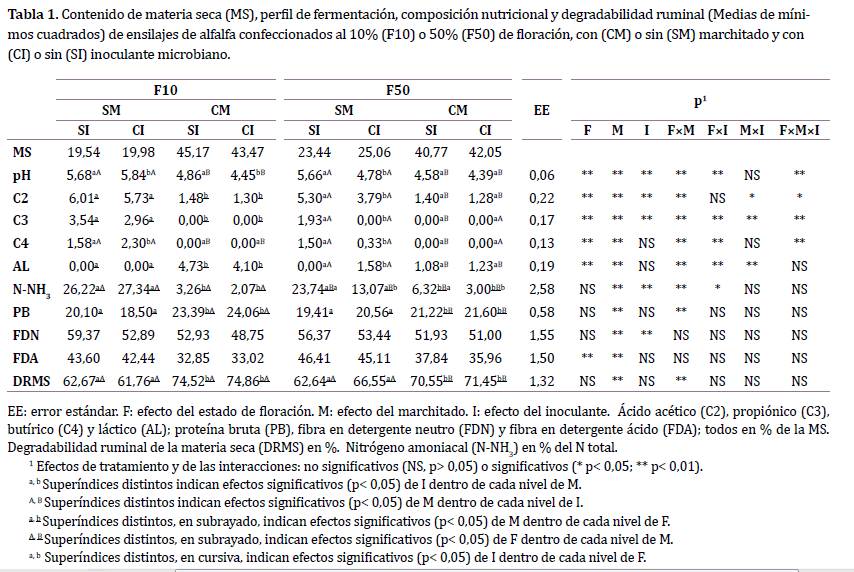
En ambos estados de floración (Tabla 1), el marchitado disminuyó consistentemente el pH de los ensilajes, ya sea en SI (-0,82 y -1,08 unidades
de pH en F10 y F50, respectivamente) como en CI (-1,39 y -0,39
unidades de pH en F10 y F50, respectivamente). En F10, la aplicación
de inoculante disminuyó el pH de los ensilajes CM (-0,41 unidades),
pero lo aumentó en SM (+0,16 unidades). Por el contrario, en F50, el
inoculante disminuyó el pH de los ensilajes SM (-0,88 unidades), pero
no tuvo efecto en CM.
En F10, los ensilajes CM tuvieron menor concentración de C2, ácido
propiónico (C3) y C4, y mayor de AL (para C4, M×I p< 0,05). En F50, en
cambio, los tratamientos CM resultaron con menor concentración de
C3 y C4 y mayor de AL solamente cuando no se aplicó el inoculante. La
excepción fue para C2, donde el marchitado disminuyó su concentración
tanto en CI como en SI.
El único efecto detectado del inoculante sobre la concentración de ácidos orgánicos fue en la combinación de F50-SM, donde su aplicación
resultó en menor contenido de C2, C3 y C4, y mayor de AL.
Al aplicar el marchitado, las concentraciones de N-NH3 se redujeron
90 y 75 % para F10 y F50, respectivamente. Por otro lado, el efecto del
inoculante sobre esta variable dependió del estado de floración. En
F50, los tratamientos CI presentaron menor concentración de N-NH3
que los SI (- 46 %), mientras que en F10 no hubo diferencias.
Los ensilajes CM presentaron mayores contenidos de PB que los
SM. Estas diferencias fueron de 23 % en F10 (23,73 vs. 19,30 %) y 7 %
en F50 (21,41 vs. 19,99 %). Por otro lado, solo cuando se aplicó marchitado
el contenido de PB difirió entre los estados fenológicos, siendo
mayor en F10 (23,73 vs. 21,41 %). Finalmente, no se halló efecto del
inoculante sobre el porcentaje de PB.
Comparado con SM, los tratamientos CM presentaron un menor
contenido de FDN (51,15 vs. 55,52 %) y FDA (34,92 vs. 44,39 %). De
manera similar, los ensilajes CI tuvieron menor FDN respecto a SI
(51,52 vs. 55,15 %). Sin embargo, no hubo efecto del inoculante sobre
el contenido de FDA (CI: 39,13 %, SI: 40,18 %).
La DRMS de los ensilajes CM fue superior a la de lo ensilajes SM.
Los incrementos fueron del 20 % en F10 (74,69 vs. 66,22 %) y 9,9 %
en F50 (64,60 vs. 71,0 %). Por otro lado, solo cuando se aplicó marchitado
hubo diferencias entre estados fenológicos, donde F10 tuvo una DRMS un 5,2 % mayor que F50. No se encontró efecto del inoculante
sobre esta variable.
El pH más adecuado para la conservación de los ensilajes de leguminosas
depende del contenido de MS. Kung et al.(20) recomiendan valores
de 4,3 a 4,7 para ensilajes con menos de 30-35 % de MS y un
pH de 4,7 a 5 para ensilajes con 45 a 55 % de MS. Si se toma un pH
de 5 como punto de corte, ninguna de las cuatro combinaciones que
incluyeron el marchitado superaron ese valor y fluctuaron entre 4,39
y 4,86, lo que sería adecuado para una correcta estabilidad del ensilaje
con los tenores de MS alcanzados (40 a 45 %). Sin embargo, dentro de
las cuatro combinaciones SM, la única en alcanzar un pH relativamente
más bajo (4,78) fue F50-CI.
El efecto marchitado sobre la reducción del pH fue biológicamente
importante (alrededor de un punto de pH), al principio de floración y
en floración media, lo que avala la práctica de realizar un marchitado
previo en ensilaje de alfalfa si no se utiliza ningún tipo de aditivo(21).
La caída del pH por efecto del marchitado puede hallarse, incluso, en
alfalfa con 100 % de floración(22).
Los inoculantes con BALHo (y BALHeF) promueven una rápida caída
del pH y un menor nivel de pH final en los ensilajes debido a una
mayor producción de AL.(3,5) Sin embargo, la magnitud de esos efectos
depende del material utilizado(6), por ejemplo, maíz vs. alfalfa. En un
metaanálisis realizado por Blajman et al.(23), que cubrió ensayos realizados
sobre alfalfa con marchitado previo, la utilización de BalHo y
BALHeF generó una reducción del pH de 0,4 unidades, pero en los trabajos
que incluyeron solamente L. plantarum, una BALHo obligada, el
efecto fue más modesto (- 0,2 unidades de pH). Los efectos del inoculante
sobre el pH en el presente trabajo fueron diferentes en las combinaciones
de tratamientos, pero de magnitud en dos situaciones de
interés práctico. En F10-CM, la categoría de mejor calidad nutricional,
el inoculante disminuyó el pH en 0,41 unidades. Por otro lado, en F50-
SM, que es una alternativa utilizada empíricamente para simplificar
la tarea de ensilado, el inoculante bajó el pH en 0,88 unidades, con un
aumento en la concentración de AL y una disminución en la de C2 y C4.
En F50-CM, se halló una tendencia (p= 0,06), pero la disminución del
pH fue menor (0,19), sin modificaciones en AL y AGV.
La capacidad de un inoculante para disminuir el pH de un ensilaje
puede depender de la concentración de MS y de flora epífita del cultivo al momento de ensilar, y de la cantidad, de la especie y de la cepa bacteriana
incluida en la formulación. A modo de ejemplo, Filya et al.(24) hallaron diferentes resultados con inoculantes comerciales a base de
L. plantarum, en alfalfas de primer y segundo corte. En alfalfa de primer
corte, la mayor concentración de MS (47,7 % MS) puede haber
restringido la fermentación en el grupo control (pH: 5,08) y aumentar
así la acción del inoculante (pH entre 4,33 y 4,51 en los grupos con L.
plantarum). Sin embargo, en alfalfa de segundo corte, que tenía 39,3
% de MS y mayor población de BAL epífitas, el pH del grupo control
fue más bajo (4,42) y el contenido de AL más elevado (8,65 %, base
MS) que en el grupo control del primer corte, y ninguno de los 3 inoculantes
con L. plantarum promovieron una mayor disminución del pH.
Similares resultados fueron informados por Contreras-Govea et al. (25),
quienes atribuyeron la falta de efecto del inoculante (L. plantarum) en
alfalfa (10 % de floración, 39,5 % MS) a una alta población epífita de
BAL, que permitió que el grupo control alcanzara valores bajos de pH
(4,58) y elevada concentración de AL (7,65 %, base MS). Si bien en el
presente trabajo no se estudió la concentración de flora epífita, una
concentración bacteriana igual o superior a la dosis de inoculante aplicada
podría explicar la falta de efectos del inoculante sobre el pH en
algunos de los tratamientos, y su evaluación debería tenerse en cuenta
para futuros experimentos.
Se ha informado que, al aumentar el contenido de MS del cultivo, los
inoculantes pueden producir una mayor fermentación láctica y disminuir
el pH del ensilaje más rápida y eficientemente. La aplicación de
L. plantarum en combinación con Propionibacterium acidipropionici
disminuyó el pH cuando se aplicó en alfalfa con marchitado, pero lo
aumentó cuando esta técnica no fue empleada. Sin embargo, no hubo
efectos cuando se usó L. plantarum solo(9). Lo hallado con ambos inoculantes
combinados concuerda con nuestro trabajo, en el cual la disminución
del contenido de agua, ya sea por la aplicación de marchitado
o por el avance del estado fenológico, permitió que los ensilajes CI
presenten menor pH que los SI.
El efecto de marchitado en F10 (aumento de AL y disminución de
AGV) está en línea con una fermentación láctica y la disminución del
pH hallada, de igual manera a lo sucedido en F50-SI. Sin embargo, en
F50-CI, el marchitado provocó un descenso del pH, sin modificaciones
claras en los ácidos orgánicos que lo expliquen.
Las altas concentraciones de N-NH3, C2, C3 y C4, y los altos valores
de pH hallados en los ensilajes SM, a excepción de F50-SM-CI, sumado
al olor desagradable percibido (caracteres organolépticos no informados),
son indicios del crecimiento de clostridios(20). El bajo contenido
de MS explicaría este tipo de fermentación indeseable. Cuando el contenido de MS supera el 30 a 35 %, la elevada presión osmótica inhibe
el crecimiento de los clostridios (20). Este tipo de ensilajes con fermentaciones
indeseables no solamente conlleva pérdidas de MS, sino
que puede comprometer el desempeño productivo de los animales. En
el presente trabajo, los ensilajes en F10-SM y F50-SM-SI presentaron
un promedio de 1,8 % de ácido butírico que podría resultar en una
ingesta diaria de más de 120 g (vaca de 650 kg de peso vivo, consumo
del 3,5 % del peso vivo, 30 % de ensilaje de alfalfa en la ración). Un
consumo diario de más de 50-100 g de ácido butírico podría aumentar
los riesgos de incidencia de cetosis en vacas lecheras(26).
En F10-SM hay una coincidencia entre la falta de efecto del inoculante
sobre el pH y la imposibilidad de establecer una fermentación
láctica en estas condiciones, con niveles de AL indetectables.
Coincidentemente, Hashemzadeh-Cigari et al.(9) tampoco hallaron
efectos sobre las concentraciones de ácidos orgánicos cuando utilizaron
un inoculante a base de L. plantarum en alfalfa en prefloración sin
oreo. En F10-CM, la disminución del pH producida por el inoculante
no es explicada por ninguna modificación de los ácidos orgánicos medidos,
a diferencia de otros ensayos con L. plantarum(27,28) en los que se
asoció a un incremento de AL. Las concentraciones de ácidos orgánicos
en F50-SM fueron alteradas por el inoculante en forma similar a lo
hallado por Liu et al.(29), en ensilaje de alfalfa florecida sin marchitado
previo, y demuestra un efecto positivo de L. plantarum en una situación
menos desafiante que la hallada en F10-SM. En F50-CM se generó un pH adecuado en el grupo SI y el inoculante no tuvo efecto sobre las
concentraciones de ácidos orgánicos.
Al igual que lo observado para la variable pH, la falta de efectos del
inoculante sobre AL y AGV, en especial en F10-CM y F50-CM, podría
atribuirse a la presencia de flora epífita en concentraciones superiores
a la dosis de inoculante empleada(24).
El incremento de la DRMS provocada por el marchitado muestra
una relación con la disminución en el contenido de FDA y la mejor conservación
de los componentes más digestibles del forraje. Como sucede
con la alfalfa en pastoreo directo, el avance del estado fenológico
tuvo como consecuencia una disminución de la DRMS en los cortes
CM.
La falta de efecto del inoculante a base de L. plantarum sobre la
DRMS coincide con los resultados de producción de gas in vitro(25) y de degradabilidad in vitro de la MS publicados en otros trabajos(31).
De manera similar, Filya et al.(24) hallaron que la inoculación con BAL
mejoró parámetros de fermentación, como pH y niveles de ácidos orgánicos
(disminuyó C2 e incrementó AL), pero no tuvo efecto sobre la
digestibilidad in vitro de la MS a las 48 h.
Hashemzadeh-Cigari et al.(9) hallaron que la inoculación con L. plantarum
y Propionibacterium acidipropionici aumentó la DRMS a las 24 h
en ensilajes de alfalfa con marchitado, mientras que L. plantarum tuvo
este efecto en los ensilajes sin marchitado, lo que significó una interacción
I x M, situación que no se observó en nuestro trabajo. Sin embargo,
Hashemzadeh-Cigari et al.(9) no hallaron cambios en la DRMS por
efecto del marchitado.
El marchitado del forraje contribuye a mejorar el proceso de fermentación
y la degradabilidad ruminal de ensilajes de alfalfa en floración
temprana y media, lo cual la sitúa como una práctica de elección
para la confección de este tipo de reservas forrajeras. En F10-CM y
en F50-CM la aplicación del inoculante, al menos en las condiciones
de este ensayo, no produce mejoras adicionales de importancia. Sin
embargo, en F50-SM, una situación a la que puede llegarse por dificultades
técnicas para realizar el oreado, la aplicación de L. plantarum mejora los parámetros fermentativos del ensilaje.
1. Basigalup DH. Situación de la alfalfa en Argentina. 5º Jornada Nacional de Forrajes Conservados, 9 y 10 de abril de 2014, INTA Manfredi, Córdoba, Argentina.
2. Bragachini M, Cattani P, Gallardo M, Peiretti J. Forrajes conservados de alta calidad y aspectos relacionados al manejo nutricional. Manual Técnico N° 6, INTA-PRECOP II. 2008. INTA E.E.A. Manfredi, Córdoba, Argentina.
3. Weinberg ZG, Muck RE. New trends and opportunities in the development and use of inoculants for silage. FEMS Microbiol Rev. 1996; 19(1):53-68. doi:10.1111/j.1574-6976.1996.tb00253.x.
4. Pahlow G, Muck RE, Driehuis F, Oude Elferink SJWH, Spoelstra SF. Microbiology of ensiling. In: Buxton DR, Muck RE, Harrison JH (eds). Silage science and technology. American Society of Agronomy, Inc., Madison, USA. 2003.
5. Muck RE, Nadeau MG, McAllister TA, Contreras-Govea FE, Santos MC, Kung LJr. Silage review: Recent advances and future uses of silage additives. J Dairy Sci. 2018; 101(5):3980-4000. doi:10.3168/jds.2017-13839.
6. Oliveira AS, Weinberg ZG, Ogunade IM, Cervantes AAP, Arriola KG, Jiang Y, Kim D, Li X, Gonçalves MCM, Vyas, D. Meta-analysis of effects of inoculation with homofermentative and facultative heterofermentative lactic acid bacteria on silage fermentation, aerobic stability, and the performance of dairy cows. J Dairy Sci. 2017; 100(6):4587- 4603. doi:10.3168/jds.2016-11815.
7. Jaurena G, Danelón JL. Tabla de composición de alimentos para rumiantes de la región pampeana argentina. Buenos Aires: Editorial Hemisferio Sur S.A.; 2006.
8. Oude Elferink, SJWH, Driehuis F, Gottschal JC, Spoelstra SF. Silage fermentation processes and their manipulation. En: FAO Electronic Conference on Tropical Silage, 1 September-15 December, 1999. p. 1-28.
9. Hashemzadeh-Cigari F, Khorvash M, Ghorbani GR, Taghizadeh A. The effects of wilting, molasses and inoculants on the fermentation quality and nutritive value of lucerne silage. S Afr J Anim Sci. 2011; 41(4):377-88. doi:10.4314/sajas.v41i4.8.
10. Whiter AG, Kung LJr. The effect of a dry or liquid application of Lactobacillus plantarum MTD1 on the fermentation of alfalfa silage. J Dairy Sci. 2001; 84(10):2195-202. doi:10.3168/jds.S0022-0302(01)74666-8.
11. Petruzzi HJ, Stritzler NP, Ferri CM, Pagella JH, Rabotnikof CM. Determinación de materia seca por métodos indirectos: utilización del horno a microondas. En: Boletín de Divulgación Técnica Nº 88. 2005. INTA - Facultad de Agronomía, UNLPam, Anguil, Argentina. p. 8-11.
12. Friggens NC, Oldham JD, Dewhurst RJ, Horgan G. Proportions of volatile fatty acids in relation to the chemical composition of feeds based on grass silage. J Dairy Sci. 1998; 81(5):1331-44. doi: 10.3168/jds.S0022-0302(98)75696-6.
13. Weatherburn, MW. Phenol-hypochlorite reaction for determination of ammonia. Anal Chem. 1967; 39(8):971-74. doi: 10.1021/ac60252a045.
14. Association of Official Analytical Chemists. Official methods of analysis. 17th Ed. AOAC. Arlington, USA. 2000.
15. Van Soest PJ, Robertson JB, Lewis BA. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J Dairy Sci. 1991; 74(10):3583-97. doi:10.3168/jds.S0022-0302(91)78551-2.
16. Vanzant E, Cochran R, Titgemeyer E. Standardization of in situ techniques for ruminant feedstuff evaluation. J Anim Sci. 1998; 76(10):2717-29. doi: 10.2527/1998.76102717x.
17. Huntington JA, Givens DI. Studies on in situ degradation of feeds in the rumen: 1. Effect of species, bag motility and incubation sequence on dry matter disappearance. Anim Feed Sci Technol. 1997; 64(2-4):227-41. doi: 10.1016/S0377-8401(96)01057-7.
18. Michalet-Doreau B. Ould-Bah MY. In vitro and in sacco methods for the estimation of dietary nitrogen degradability in the rumen: a review. Anim Feed Sci Technol. 1992; 40(1):57–86. doi: 10.1016/0377-8401(92)90112-J.
19. SAS Institute Inc. SAS/STAT 9.1 User’s Guide. Cary, NC, USA. 2004.
20. Kung LJr, Shaver RD, Grant RJ, Schmidt RJ. Silage review: Interpretation of chemical, microbial, and organoleptic components of silages. J Dairy Sci. 2018; 101(5): 4020- 4033. doi:10.3168/jds.2017-13909.
21. Albrecht KA, Beauchemin KA. Alfalfa and other perennial legume silage. In: Silage science and technology. 2003. D.R. Buxton, R.E. Muck, J.H. Harrison, Eds. ASA, CSSA and SSSA. Madison, USA. p. 633-64.
22. Zheng M, Niu D, Zuo S, Mao P, Meng L, Xu C. The effect of cultivar, wilting and storage period on fermentation and clostridial community of alfalfa silage. Ital J Anim Sci. 2018; 17(2):336-46. doi:10.1080/1828051X.2017.1364984.
23. Blajman JE, Vinderola G, Páez RB, Signorini RL. The role of homofermentative and heterofermentative lactic acid bacteria for alfalfa silage: a meta-analysis. J Agric Sci. 2020; 158(1-2):107-18. doi:10.1017/S0021859620000386.
24. Filya I, Muck RE, Contreras-Govea FE. Inoculant effects on alfalfa silage: Fermentation products and nutritive value. J Dairy Sci. 2007; 90(11):5108-14. doi: 10.3168/ jds.2006-877.
25. Contreras-Govea FE, Muck RE, Mertens DR, Weimer PJ. Microbial inoculant effects on silage and in vitro ruminal fermentation, and microbial biomass estimation for alfalfa, bmr corn, and corn silages. Anim Feed Sci Technol. 2011; 163(1):2-10. doi: 10.1016/j.anifeedsci.2010.09.015.
26. Oetzel GR. Herd-level ketosis - Diagnosis and risk factors. In: Proc. Preconference Seminar 7C: Dairy herd problem investigation strategies: Transition cow troubleshooting. 2007. Vancouver, BC, Canada, p. 67-91.
27. Zhang T, Li L, Wang X, Zeng Z, Hu Y, Cui Z. Effects of Lactobacillus buchneri and Lactobacillus plantarum on fermentation, aerobic stability, bacteria diversity and ruminal degradability of alfalfa silage. World J Microbiol Biotechnol. 2009; 25(6):965-71. doi: 10.1007/s11274-009-9973-x.
28. Guo XS, Ke WC, Ding WR, Ding ML, Xu DM, Wang WW, Zhang P, Yang FH. Profiling of metabolome and bacterial community dynamics in ensiled Medicago sativa inoculated without or with Lactobacillus plantarum or Lactobacillus buchneri. Sci Rep. 2018; 8:357. doi:10.1038/s41598-017-18348-0.
29. Liu QH, Dong ZH, Shao T. Effect of additives on fatty acid profile of high moisture alfalfa silage during ensiling and after exposure to air. Anim Feed Sci Technol. 2018; 236(1):29-38. doi:10.1016/j.anifeedsci.2017.11.022.
30. Rangrab, LH, Frenzel Mühlbach PR, Berto JL. Silagem de alfalfa colhida no início do florescimento e submetida ao emurchecimento e à ação de aditivos biológicos. Rev Bras Zootec. 2000. 29(2):349-356. doi:10.1590/S1516-35982000000200005.
31. Hashemzadeh-Cigari F, Khorvash M, Ghorbani GR, Ghasemi E, Taghizadeh A, Kargar S, Yang WZ. Interactive effects of molasses by homofermentative and heterofermentative inoculants on fermentation quality, nitrogen fractionation, nutritive value and aerobic stability of wilted alfalfa (Medicago sativa L) silage. J Anim Physiol Anim Nutr. 2014; 98(2):290-99. doi:10.1111/jpn.12079.
Fecha de recepción del artículo: 03/03/2022
Fecha de aceptación para su publicación: 07/04/2022