DOI: http://dx.doi.org/10.19137/cienvet202224206
![]() Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No Comercial-
Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
ARTÍCULO DE REVISIÓN
Análisis y revisión de la variación del MHC-B en
pollos. Síntesis del trabajo en líneas sintéticas
INTA
Analysis and review of the variation of MHC-B in
chickens. Synthesis of work on INTA synthetic lines.
Análise e revisão da variação do MHC-B em frango.
Síntese de trabalho em linhas sintéticas INTA
Iglesias GM.
Universidad Nacional de Río Negro. Sede Alto Valle y Valle Medio. Escuela de Veterinaria y Producción
Agroindustrial. Cátedra de Genética. Pacheco 460. Choele Choel, Rio Negro. 8360. Argentina.
Correo electrónico: giglesias@unrn.edu.ar
RESUMEN: El complejo mayor de Histocompatibilidad (MHC del inglés: Major
histocompatibility complex) en pollos (Gallus gallus) se encuentra localizado
en el micro cromosoma 16 del genoma aviar. Así como ocurre
en otras especies, tiene una fuerte asociación con la resistencia genética
a enfermedades. Esta característica multigénica es particularmente
deseada para la selección de esta especie, en particular por su relación
con el bienestar animal. En este trabajo se pretende revisar los conocimientos
sobre el análisis de la variabilidad del MHC-B en pollos y sus
metodologías de análisis y una síntesis de los trabajos realizados en
pollos Campero INTA.
Palabras Clave: Complejo mayor de Histocompatibilidad, Pollos,
Gallus gallus, SNPs, Campero INTA
ABSTRACT: The major histocompatibility complex (MHC) in chickens (Gallus
gallus) is located on the 16th micro chromosome, of the avian genome.
As in other species, it has a strong association with genetic resistance
to diseases. This multigenic feature is particularly desired for the selection
of this species, in particular because of its relationship with animal
welfare. This paper aims to review the knowledge on the analysis
of the variability of MHC-B in chickens and its analysis methodologies,
and a synthesis of the work done on Campero INTA chickens.
Key words: Major Histocompatibility Complex, Chickens, Gallus
gallus, SNPs, Campero INTA
RESUMO: O complexo maior de histocompatibilidade (MHC) em frangos
(Gallus gallus) está localizado no microcromossomo 16 do genoma
aviário. Como em outras espécies, tem forte associação com resistência
genética a doenças. Esta característica multigénica é particularmente
desejada para a seleção desta espécie, nomeadamente pela
sua relação com o bem-estar animal. Este artigo pretende revisar o
conhecimento sobre a análise da variabilidade do MHC-B em frangos e
suas metodologias de análise e uma síntese do trabalho realizado em
frangos Campero INTA.
Palavras-chave: Complexo Maior de Histocompatibilidade,
Galinhas, Gallus gallus, SNPs, Campero INTA.
COMPLEJO MAYOR DE HISTOCOMPATIBILIDAD (MHC) EN POLLOS
En Gallus gallus, el MHC es llamado “Complejo o sistema B” por
considerarse originalmente un grupo sanguíneo distinto del A, previamente
descripto. Por otro lado, esta confusión se debió al hecho de
que las moléculas se expresan en los eritrocitos, por ser nucleados. A
través de la serología, se hallaron 28 serotipos diferentes del Complejo
B en aves de postura (1,2). Más tarde se demostró que estas moléculas B
tenían las mismas funciones que las moléculas de histocompatibilidad
(3), pero a pesar de ello, la nomenclatura que se utiliza para los genes
del MHC en aves sigue siendo B. Por ello hay tres tipos de genes: a los genes de clase I se los denomina B-F; a los de clase II, B-L y un tercer
grupo, sólo presentes en las aves de la familia de las gallináceas, de
clase IV o B-G.
En los comienzos, se determinó la existencia de 6 genes homólogos
a las secuencias de los genes humanos de clase I, y 5 genes o secuencias
homólogas a las de clase II. Esto pudo detectarse por medio de
técnicas de “chromosome walking” en una genoteca de pollos de raza
Leghorn homocigotas para el serotipo B12. Por entonces se dudó si el
número de copias era el mismo en los pollos de distintos serotipos o
solamente se mantenía en los animales de serotipo B12. Estas 6 copias
fueron llamadas del B-F I al VI (4). Por medio de trabajos de hibridación
con una sonda completa del gen B-F, logró descubrirse que existen
solamente dos transcriptos en tejidos normales, uno con mayor tasa
de expresión que el otro. De ello se planteó la existencia de sólo dos
copias de los genes de clase I en el Complejo B de los pollos, los cuales
son el B-F IV, llamado mayor por su tasa de expresión y el B-F I, llamado
menor. Ya en la actualidad se denominan B-F I y B-F II. Se observó que los genes B-F II, III, V y VI no tienen el extremo 3’ completo, lo
que impediría que se produzca una correcta expresión de estos en las
células. Posteriormente se descubrió que se trataba de los genes del
Sistema Rfp-Y (5).
El sistema Rfp-Y codifica moléculas de clase I y II atípicas, similares
a las encontradas en el MHC de mamíferos como, por ejemplo, los genes
Mic. Esta afirmación se basó originalmente en el bajo polimorfismo
y la baja divergencia que presentan las secuencias de los genes de
dichas moléculas; como así también por el bajo nivel de expresión, la
carencia de fuertes efectos en el rechazo a injertos, la pobre reacción
con linfocitos y poca relación con la resistencia a enfermedades (5,6).
Posteriormente, pudieron determinar que al menos una copia de los
genes de clase I del sistema Rfp-Y, el YF-V, se expresa y es altamente
polimórfico en el sitio de unión al antígeno (7).
El Complejo B presenta la característica de ser muy compacto en
cuanto a la región cromosómica que ocupa en comparación con el
MHC de los mamíferos. Como ejemplo podemos señalar que todo el
complejo B ocupa 250 kilobases (kb), mientras que la región del HLA
(Human leukocyte antigen) ocupa aproximadamente 4 megabases (8).
Las moléculas de histocompatibilidad de Clase I (B-F) son las encargadas
de la presentación antigénica de los péptidos endógenos, como
por ejemplo los de origen viral o tumoral, y se expresan en la superficie
de casi todas las células del organismo, con excepción de los glóbulos
rojos, los trofoblastos y las neuronas. Los genes de clase II (B-L)
codifican las moléculas encargadas de presentar los péptidos de origen
exógeno, por ejemplo: bacterias, hongos, y solo se expresan en las células presentadoras de antígenos (CPA), como macrófagos y células
de Langerhans. Las moléculas de clase IV (B-G) solo se han encontrado
en las aves y no pudo determinarse la existencia de una contrapartida
en los mamíferos, aunque se parecen mucho a la butirofilina. Se expresan
en los eritrocitos, linfocitos, células del epitelio intestinal, bursa de
Fabricio y Timo, y aún no ha podido determinarse su función en forma
concreta, aunque se describió una posible función coadyuvante de las
moléculas B-F en la activación de los linfocitos T CD8. (9,10)
ORGANIZACIÓN DE LOS GENES DEL MHC DE LOS POLLOS
El Complejo B en los pollos se halla compuesto por una serie de genes
relacionados con la respuesta inmune. En el cromosoma 16 se halla
la región o cluster B-F/B-L, la que contiene dos copias de los genes
de Clase I y dos copias de los genes de Clase II β. Junto a los genes B-F
y B-Lβ se encuentran ligados otros genes relacionados con la presentación
antigénica y la respuesta inmune como, por ejemplo: una copia
de los genes B-G, genes Tap 1 y 2 (encargados de la carga del antígeno
en el surco de las moléculas de Clase I), gen C4 del complemento, etc.
Un mapa simplificado se muestra en las Figuras 1 y 2.
MARCADORES MOLECULARES DEL MHC
Las determinaciones serológicas presentan una buena correlación
con la caracterización molecular de los genotipos del MHC. El análisis
a nivel molecular de los genes que conforman el MHC presenta una
ventaja adicional, ya que por medio de estos tipos de análisis es posible
detectar mejor la variabilidad de los genes de clase I y II, que pueda
pasar inadvertida en las determinaciones serológicas. La serotipificación
se ha desarrollado principalmente en líneas consanguíneas de
aves de postura (Leghorn) y los antisueros no han sido muy efectivos
a la hora de caracterizar líneas de aves para carne, por tal motivo la
caracterización de los genes del MHC es una herramienta de fundamental
importancia en el estudio de los pollos para carne
El microsatélite LEI0258 se halla ligado aproximadamente a 50.000
pares de bases (pb) de los genes B-F en el cromosoma 16 de las aves.
Esta distancia equivale a 0,5 centimorgan (cM), lo que indica que es un
buen marcador del complejo B.Se ha encontrado una asociación entre los patrones de herencia de
este microsatélite con los 28 serotipos descriptos(2). El microsatélite
tiene pocos alelos y los serotipos homocigotas tienen una sola banda
de amplificación de este microsatélite, mientras que los heterocigotas
presentan dos. Según el tamaño de las bandas y del número de repeticiones del microsatélite puede distinguirse a los distintos serotipos
y los genotipos de los animales analizados (13,14). Para nuestra población
en estudio esto es de gran utilidad debido a que los anticuerpos
generados en aves de postura no dan reacciones específicas en
pollos para carne. El microsatélite LEI0258 es una región repetitiva de
la siguiente secuencia de 12 o 13 pares de bases: (CCTTCTTTCTTTn)
(14). Esta secuencia se repite un número variable de veces (n) y está flanqueada por regiones conservadas, lo que permite seleccionar oligonucleótidos
apropiados para la amplificación de dicho marcador
por la técnica de reacción en cadena de la polimerasa (PCR).
Cada animal hereda una copia del microsatélite de cada uno de sus
progenitores, lo que permite distinguir la herencia de los patrones de
dicho microsatélite y por ende el haplotipo al cual está ligado.
RELEVANCIA DEL ESTUDIO DE LOS GENES DE CLASE I DEL MHC EN POLLOS
El MHC ha mostrado tener una gran importancia en la determinación
de la resistencia/susceptibilidad en aves a distintos patógenos
como: bacterias, parásitos y virus (15,16).
Se ha encontrado una asociación entre determinados serotipos
del MHC y la resistencia o susceptibilidad a la Enfermedad de Marek
(16). Ésta es una enfermedad linfoproliferativa de las aves causada por
un herpesvirus, el virus de la enfermedad de Marek (MDV: del inglés
Marek Disease Virus). Esta enfermedad se caracteriza por desmielinización
del sistema nervioso periférico y linfoma de células T. Se ha demostrado
que los pollos que presentan el serotipo B21 por medio de
detección serológica, son resistentes a la enfermedad de Marek, mientras
que los individuos con serotipo B19 o B13 son susceptibles a la
enfermedad (17). La mortalidad producida por la infección con el MDV
es baja, sin embargo, presenta una alta morbilidad y las lesiones que
se producen en los pollos afectados son una de las principales causas
de la reducción en la calidad y en los niveles de producción avícola.
Esta enfermedad se controla por medio de la vacunación, siendo ésta
más efectiva, en animales genéticamente resistentes al virus (18). Se reconocieron
tres mecanismos principales de la resistencia genética a
Marek: la resistencia asociada al MHC, la resistencia asociada a genes
MHC atípicos (Rfp-Y) y la resistencia dada por la variación en la susceptibilidad
de las células T a la transformación por parte del virus
(15,19). Dada la importancia económica que representa la obtención de
animales genéticamente resistentes a distintas enfermedades, se han
seleccionado líneas de pollos resistentes y susceptibles a la enfermedad
de Marek(20). En este caso particular, los animales serológicamente conocidos como B21, poseen una tasa de supervivencia del 85 % frente
a la descarga con el virus
Esta capacidad que presentarían algunos serotipos del MHC en
otorgar resistencia a determinados patógenos estaría explicada por la
teoría del Mínimo Esencial planteada por James Kaufman (8). Esta teoría
plantea que, al ser las moléculas de los pollos tan poco variables en
comparación con las de los mamíferos, existirían en la naturaleza alelos
y copias de los genes de histocompatibilidad que son “mejores” en
la presentación antigénica de los péptidos virales. Esta capacidad para
presentar péptidos endógenos de un modo más eficiente por parte de
las moléculas de clase I (B-F) daría a esa variante o serotipo una mayor
capacidad del sistema inmune para responder, y en consecuencia,
una resistencia de los animales ante las patologías. Por otro lado, en
caso de que la variante de los genes no sea una “buena presentadora
antigénica”, la respuesta inmune será menor y los animales serán más
susceptibles al patógeno.
En cuanto a los pollos para carne, se han realizado pocos estudios
al respecto. El grupo que comenzó con estos estudios para tratar de
lograr serotipificación de líneas de carne fue el de Sandy Ewald en
Auburn, EE. UU. En una línea comercial de pollos para carne se determinaron
3 serotipos del MHC. A esta línea se la denominó línea C,
nombre fantasía con el fin de preservar la información genética de dichas
líneas (12). El mismo grupo de trabajo logró determinar secuencias
parciales de la región α1 y α2 de los genes B-F de las líneas para carne
denominadas A, B y C. En ellas se encontraron, como era de esperar
secuencias pertenecientes a haplotipos únicos en parrilleros como el
C2v, A12, C7 entre otros (21,22).
De los tres genes mayores (moléculas que presentan antígenos)
que conforman el MHC de las aves (B-F, B-L y B-G), se ha encontrado
que existe una correlación entre los distintos genotipos de los genes
B-F y la existencia o no, de susceptibilidad a Enfermedad de Marek. Se
observó que los animales recombinantes (B-G21, B-F19) fueron igualmente
susceptibles al virus de la Enfermedad de Marek que los pollos
de serotipo B19. Los genes asociados al Complejo B e involucrados con
la resistencia a la Enfermedad de Marek fueron localizados en la región
B-F/B-L del cromosoma 16 (23). Sin embargo, otros trabajos describen
diferencias en la tasa de mortalidad en animales de idéntico genotipo
para los genes B-F y que presentaban diferencias en los genes B-G (24).
Del mismo modo que con la serotipificación, la mayoría de los trabajos
que se han hecho estudiando la relación existente entre el MHC
y la resistencia a Enfermedad de Marek, fue llevada a cabo en aves de
postura.
La caracterización de los genes de Clase I, a través de técnicas de biología
molecular, es de importancia debido al hecho de que se trata de
una población no caracterizada serológicamente. Esta caracterización
se realizó por medio de las técnicas de: Polimorfismo de Longitud de
los Fragmentos de Restricción (RFLP del inglés: Restriction Fragment
Length Polymorphism) y Polimorfismo Conformacional de Cadena
Simple (SSCP del inglés: Single Strand Conformation Polymorphism) en
la línea AH de Pollos Campero-INTA (25) así como en otras poblaciones,
demostrando su utilidad (26).
La determinación de secuencias de los genes de clase I por medio
de secuenciación automática es una técnica muy precisa, pero muy
costosa. Estas secuencias se realizan en animales de líneas homocigotas,
lo que ha generado una gran cantidad de reportes existentes
en el GenBank de los transcriptos de genes B-F de la mayoría de los
serotipos conocidos.
Recientemente en 2016, Fulton et al. (27) desarrollaron un panel de
análisis de la variación de 90 polimorfismos de un solo nucleótido
(SNPs) abarcando la región más importante del MHC hasta llegar a la
región de los genes B-G, sin incluirlos. Esta región contiene a los genes
de clase I y clase II y sus genes intermedios, alrededor de 16 de ellos
en su mayoría involucrados en la respuesta inmune. De esta forma, el
análisis de la variabilidad en distintas razas y líneas se hace mucho
más completo y preciso.
TÉCNICAS UTILIZADAS PARA LA DETECCIÓN DE GENOTIPOS Y HAPLOTIPOS DEL MHC
Se han utilizado varias técnicas basadas en ADN para examinar la
diversidad MHC-B en pollos. La técnica de Southern blot que utiliza
sondas específicas de genes más importantes del MHC-B ha revelado
gran diversidad MHC-B en muchas razas de pollos. (25,28–30) La técnica
de SSCP (Single-Strand Conformation Polymorphism) se ha utilizado
para examinar pequeñas regiones de genes específicos (26). La secuenciación
directa de genes específicos también se ha utilizado para identificar
los haplotipos (12,31,32) .Estas técnicas fueron particularmente útiles
para examinar la variación de MHC en pollos de diferentes razas.
Sin embargo, todas estas técnicas no son adecuadas para el análisis de
un gran número de animales y además son laboriosas y costosas.
El microsatélite LEI0258 es una región STR (repeticiones cortas en
tándem) situada dentro del MHC-B: LEI0258 contiene repeticiones en
tándem de 12 y 13 pb más varias deleciones en la región flanqueante
que dan lugar a las diferencias de tamaño que determinan los distintos
alelos (13,14). Debido al gran tamaño de las dos repeticiones en tándem, la variación de tamaño alélico es grande. Los alelos pueden distinguirse
fácilmente utilizando electroforesis para separar los productos
de PCR en geles de agarosa. Casualmente, los tamaños de los alelos
del marcador coinciden con los serotipos definidos previamente, por
ejemplo, el haplotipo B21 tiene un alelo de 357 pb permitiendo inferir
el serotipo. Chazara et al., 2013 (33) detectaron 79 alelos LEI0258
en un estudio realizado a 80 poblaciones de pollos de varios países.
El marcador LEI0258 se ha utilizado para identificar la variación de
MHC-B en las líneas Leghorn, de postura de huevos así como en biotipos
de pollos originarios de múltiples países (14), incluyendo África,
Irán, Corea, India y en Argentina en líneas sintéticas INTA (27,34 y 39).
Aun cuando sigue utilizándose el marcador LEI0258 por su simplicidad
y bajo costo, hay limitaciones para la detección de haplotipos del
MHC-B con el mismo. Diferentes haplotipos MHC-B pueden tener el
mismo tamaño de alelo LEI0258, de modo que no siempre es preciso.
Hay algunos serotipos que dan dos tamaños de bandas con el marcador.
Dado que los microsatélites poseen una alta tasa mutacional, la
mutación en el marcador puede dar lugar a diferentes tamaños de alelos LEI0258 que se encuentran dentro de los mismos haplotipos MHCB(14,27). Además, pueden producirse diferencias en las estimaciones detamaño de alelo realizadas en diferentes laboratorios y confundir laclaridad de las asignaciones de tipo. Dado que LEI0258 es un marcadorúnico, solo se evalúa una posición dentro del MHC.
Más recientemente se ha desarrollado una nueva metodología de
detección de SNPs para analizar la región del MHC-B. Un panel de 90
SNPs que abarca 210.000 pb de la región de pollo MHC-B fue desarrollado
inicialmente por Chazara et al. (40) y perfeccionado luego por
Fulton et al. (27). Este panel fue posteriormente modificado y ampliado
para incluir un gen BG adicional en uno de los extremos y validado en
varias pruebas de genotipado con múltiples líneas de pollo, razas de
locales y pollos de aves silvestres de las que se supone que deriva el
pollo doméstico (Red Jungle fowl) (27,41,42). El panel SNP, que incluye al
marcador VNTR LEI0258, ha hecho que sea fácil distinguir los haplotipos,
identificar nuevos recombinantes y definir la variación de MHC en
pollos de múltiples fuentes. Este panel de SNPs demostró que es especialmenteútil para analizar la variabilidad de MHC y establecer haplotipos
denominados BSNPs (38,39,42,43).Cada animal tiene dos haplotipos,
cada uno da como resultado una combinación heredada de cualquiera
de los padres. Por lo tanto, en nuestros estudios publicados con pollos
Campero-INTA (38y39) tratando de utilizar ambas metodologías: un primer
escaneo con LEI0258 y posteriormente, el panel SNP descrito por
Fulton et al., 2016, para identificar posibles recombinantes o nuevos
haplotipos (27). La figura 3 muestra un ejemplo de cómo se comparan los SNPs de todas las posiciones indicadas en la figura 2 y cómo se
evalúan los nuevos haplotipos incluyendo los posibles recombinantes
(Figura 3).
LÍNEAS SINTÉTICAS DE POLLOS PARA CARNE INTA
La cría de pollos para carne necesita una gran inversión de capital
para formar parte del sistema de integración que rige el mercado del
pollo en galpones industriales y dio lugar a que muchos pequeños y
medianos productores fueran marginados de él, a pesar de tener experiencias
y las instalaciones mínimas para la cría. La búsqueda de
productores naturales o ecológicos está creciendo en todo el mundo
como resultado de la convicción de que el desarrollo económico debe
ser ineludiblemente sostenible, es decir, satisfacer las necesidades de
la generación actual sin comprometer generaciones futuras, y también
por una revaloración de la “comida sana y natural”, que está vinculada
al surgimiento de la conciencia ecológica. Esta tendencia y la buena
aceptación de los productos ecológicos en las góndolas de supermercado,
augura un buen futuro para este tipo de producción.
La línea de pollos sintética “Campero” fue desarrollada por INTA
(Instituto Nacional de Tecnología Agropecuaria) en la década de los
80’s en la estación experimental ubicada en Pergamino, Buenos Aires,
Argentina por el Ing. Manuel Bonino, más adelante junto a la Dra.
Zulma E Canet, quien dirige actualmente el programa PROHUERTA
nacional. El programa PROHUERTA es un programa de políticas públicas
que promueve las prácticas productivas agroecológicas para el
autoabastecimiento, la educación alimentaria, la promoción de ferias
y mercados alternativos con una mirada inclusiva de las familias productoras.
El Campero deriva de cruces de razas estándar para proporcionar
aves de corral de crecimiento más lento que funcionan bien con
terminación a pasto, sin un insumo significativo de alimento y que estuviera
bien adaptado a las condiciones locales en las condiciones de
cría traspatio de Argentina (11).
También INTA, a través de la sección avícola de la EEA INTA
Pergamino, ha desarrollado y promovido el desarrollo de un protocolo
para la producción del Campero, basado en la normativa francesa
para la producción del pollo “Label Rouge” que en ese país ocupa hasta
un 30 % del mercado de la carne aviar. Este tipo de animal representa
otra oportunidad para generar un producto diferenciado por un
sistema de producción menos intensivo. Esto permitirá la conversión
de los pequeños y medianos productores a un sistema de producción
más natural para producir pollos traspatio, ya que no requiere una sofisticada tecnología de control ambiental, sino condiciones de reproducción
semi-intensivas, con menos inversión de capital.
ASOCIACIONES PREVIAS CON LA RESPUESTA INMUNE O LOS RASGOS DE PRODUCCIÓN DE LOS HAPLOTIPOS
ENCONTRADOS
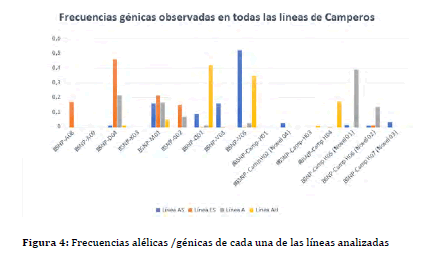
EN LÍNEAS DE CAMPERO INTATanto las frecuencias de cada haplotipo (alélicas) como los haplotipos
hallados en estas líneas sintéticas están resumidas en la Figura
4. En las poblaciones analizadas por esta metodología y que fueron
descriptas previamente, (38,39) se hallaron varios haplotipos, algunos ya
descriptos como el BSNP-D04 (conocido previamente como serotipo
B13) y que tiene un patrón de tamaño del LEI0258 de 205 pares de
bases (pb), se describió como uno de los que posee pobre resistencia
a Marek y otras enfermedades y con resistencia moderada a enfermedad
infecciosa bursal (IBD) (44).
En la bibliografía el alelo de LEI0258 de 205 bp se asoció significativamente
con las respuestas elevadas de anticuerpos primarios contra
la vacuna contra el NDV (Newcastle disease virus), (45) pero la línea B13
tuvo una mortalidad del 60 % y del 100 % en dos ensayos separados (46,47). Sin embargo, los resultados de estos ensayos deben mejorarse
porque en otras publicaciones se mostró un crecimiento tumoral diferencial
con un 94 % de regresión tumoral en las aves heterocigotas
B6/B13 en comparación con la regresión tumoral del 4 % en aves
homocigotas para B13/B13 en los casos de tumores inducidos por el
virus del sarcoma de Rous (RSV) según Schierman et al., 1977 citado
por Miller et al., 2016 (48). Curiosamente, el haplotipo B13 confiere más
resistencia a la celulitis causada por las infecciones por Escherichia
coli en comparación con B2. A pesar de estos resultados de susceptibilidad
a algunas enfermedades, el serotipo B13 se asoció positivamente
con el peso corporal(49). Se lo describe también como BF2*0401 del
haplotipo B4 (50).
La banda de amplificación de 381 bp de LEI0258, que se encuentra
en estas líneas sintéticas INTA (BSNP-V03 y V05, NOVEL 01, 02 y 03) (39) también se encontró en la línea AH (38). La región del exón 2 B-F que
fue secuenciada en 2002 (Iglesias, datos no publicados) al amplificar
el LEI0258 da una banda de amplificación de 381 pb. Esta secuencia
resultó ser idéntica a “C2v” reportada por Livant y Ewald (22) en líneas
de pollos de carne (51). Este alelo se encuentra positivamente asociado
al peso corporal (52). El alelo de 307 pb del LEI0258 (BSNP-O02 B24)
se encontró positivamente correlacionado con los rasgos de peso corporal
en algunas poblaciones de pollos (45) mientras que el alelo de 309 pb pareciera poseer una asociación negativa con la supervivencia y la
producción de huevos hasta las 72 semanas de edad (53).
Como se ha resaltado varios de los haplotipos hallados están correlacionados
con mayor peso corporal sugiriendo que una selección por
el peso ha sido realizada a lo largo de los años. Sin embargo, aún no se
han realizado selección por resistencia genética a enfermedades que
es uno de los objetivos a los que apuntan estos estudios, aprovechando
los haplotipos hallados o incorporando nuevos a las líneas parentales.
Deberían realizarse también estudios de asociación con la respuesta
inmunitaria y rasgos productivos, para continuar en la caracterización
de las líneas que originan el pollo Campero INTA como en otras
poblaciones, especialmente aquellas que realizan programas de cría y
mejora genética entre estas líneas. Por ejemplo, podría analizarse la
respuesta inmune después de la vacunación, la asociación entre haplotipos
y prevalencia de coccidiosis aviar, u otros parásitos, o, probar
infecciones virales o bacterianas, ya sea en animales vivos como en
células embrionarias de pollo.
Figura 1: Mapa del MHC simplificado y modificado del original de Miller y
Taylor 2016
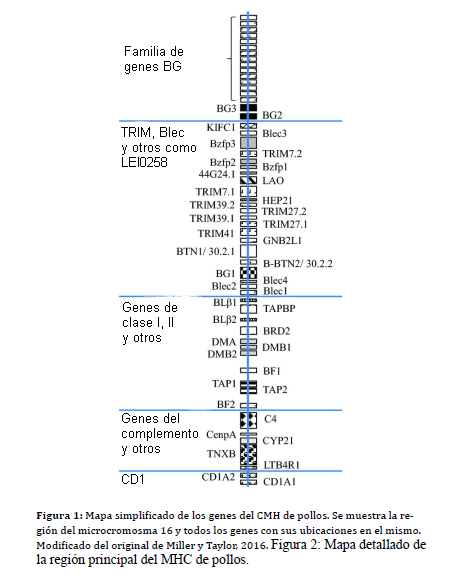
Figura 2: Mapa detallado de la región principal del MHC de pollos

Figura 3: Imagen del análisis de los SNPs usando el programa Geneious ® (54) para comparar los haplotipos nuevos con los
previamente descriptos
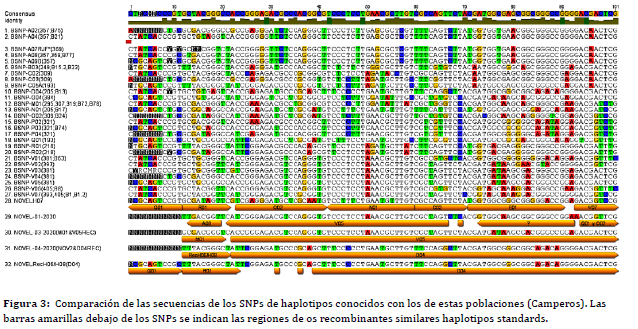
Figura 4: Frecuencias génicas o alélicas halladas en todas las líneas de
Camperos analizadas: AH, AS, A y ES
A la Universidad Nacional de Río Negro por el aporte económico
en los proyectos de investigación 40-A-498 y 40 A 485, sin los cuales
no hubiera sido posible las publicaciones que han contribuido a esta
revisión.
A la Dra. Janet Fulton por su constante apoyo a estos trabajos y su
generosidad por la colaboración con nuestro grupo.
A Jesús Arengo y María Pía Beker por sus aportes y la lectura detallada
de este escrito
A todos los alumnos y becarios de la Universidad Nacional de Río
Negro que han colaborado con el procesamiento de muestras.
1. Briles WE, McGibbon WH, Irwin MR. On multiple alleles effecting cellular antigens in the chicken. Genetics [Internet]. 1950 [cited 2018 Apr 10];35(6):633–52. Available from: http://www.genetics.org/content/genetics/35/6/633.full.pdf
2. Briles WE, Bumstead N, Ewert DL, Gilmour DG, Gogusev J, Hala K, et al. Nomenclature for chicken major histocompatibility (B) complex. Immunogenetics [Internet]. 1982 [cited 2018 Jun 26];15(5):441–7. Available from: http://link.springer.com/10.1007/ BF00345903
3. Nordskog AW, Pevzner IY, Trowbridge CL, Benedict AA. Immune response and adult mortality associated with the B locus in chickens. Adv Exp Med Biol [Internet]. 1977 [cited 2018 Apr 10];88:245–56. Available from: http://link.springer. com/10.1007/978-1-4613-4169-7_23
4. Guillemot F, Kaufman JF, Skjoedt K, Auffray C. The major histocompatibility complex in the chicken. Trends Genet. 1989;5(C):300–4.
5. Miller MM, Goto R, Zoorob R, Auffray C, Elwood Briles W. Regions of homology shared by Rfp-Y and major histocompatibility B complex genes. Immunogenetics. 1994;39(1):71–3.
6. Juul-Madsen HR, Zoorob R, Auffray C, Skjødt K, Hedemand JE. Hew chicken Rfp-Y haplotypes on the basis of MHC class II RFLP and MLC analyses. Immunogenetics [Internet]. 1997 [cited 2021 Mar 5];45(6):345–52. Available from: https://link.springer. com/article/10.1007/s002510050215
7. Afanassieff M, Goto RM, Ha J, Sherman MA, Zhong L, Auffray C, et al. At Least One Class I Gene in Restriction Fragment Pattern-Y ( Rfp-Y ), the Second MHC Gene Cluster in the Chicken, Is Transcribed, Polymorphic, and Shows Divergent Specialization in Antigen Binding Region . J Immunol. 2001 Mar 1;166(5):3324–33.
8. Kaufman J, Jacob J, Shaw J, Walker B, Milne S, Beck S, et al. Gene organisation determines evolution of function in the chicken MHC. Immunol Rev [Internet]. 1999 Feb [cited 2016 Mar 2];167(1):101–17.
9. Kaufman J, Milne S, Göbel TW, Walker BA, Jacob JP, Auffray C, et al. The chicken B locus is a minimal essential major histocompatibility complex. Nature [Internet]. 1999 Oct 28 [cited 2016 Mar 3];401(6756):923–5. Available from: http://www.ncbi.nlm.nih. gov/pubmed/10553909
10. Chen L, Fakiola M, Staines K, Butter C, Kaufman J. Functional alleles of chicken BG genes, members of the butyrophilin gene family, in peripheral T cells. Front Immunol. 2018;9(MAY).
11. Página web del INTA. p. https://inta.gob.ar/documentos/prohuerta.
12. Livant EJ, Zheng D, Johnson LW, Shi W, Ewald SJ. Three new MHC haplotypes in broiler breeder chickens. Anim Genet. 2001;32(3):123–31.
13. McConnell SKJ, Dawson DA, Wardle A, Burke T. The isolation and mapping of 19 tetranucleotide microsatellite markers in the chicken. Anim Genet [Internet]. 1999 Jun [cited 2018 Jun 26];30(3):183–9. Available from: http://doi.wiley. com/10.1046/j.1365-2052.1999.00454.x
14. Fulton J, Juul-Madsen H, Ashwell C, McCarron A, Arthur J, O’Sullivan N, et al. Molecular genotype identification of the Gallus gallus major histocompatibility complex. Immunogenetics [Internet]. 2006;58(5):407–21. Available from: http://dx.doi. org/10.1007/s00251-006-0119-0
15. Bacon LD. Influence of the major histocompatibility complex on disease resistance and productivity. Vol. 66, Poultry science. 1987. p. 802–11.
16. Lamont SJ. The chicken major histocompatibility complex in disease resistance and poultry breeding. J Dairy Sci [Internet]. 1989 May 1 [cited 2016 Mar 3];72(5):1328–33. Available from: http://www.journalofdairyscience.org/article/ S0022030289792407/fulltext
17. Kaufman J, Salomonsen J. The “Minimal Essential MHC” revisited: Both peptide-binding and cell surface expression level of MHC molecules are polymorphisms selected by pathogens in chickens. Hereditas. 1997;127(1–2):67–73.
18. Bacon LD, Witter RL. Influence of B-Haplotype on the Relative Efficacy of Marek’s Disease Vaccines of Different Serotypes. Avian Dis [Internet]. 1993 Jan [cited 2018 Apr 10];37(1):53. Available from: https://www.jstor.org/ stable/1591457?origin=crossref
19. Wakenell PS, Miller MM, Goto RM, Gauderman WJ, Briles WE. Association between the Rfp-Y haplotype and the incidence of Marek’s disease in chickens. Immunogenetics [Internet]. 1996 Jan [cited 2016 Mar 3];44(4):242–5. Available from: http:// www.ncbi.nlm.nih.gov/pubmed/8753853
20. Cole RK. Studies on Genetic Resistance to Marek’s Disease. Avian Dis. 1968 Feb;12(1):9.
21. Ewald SJ, Livant EJ. Distinctive polymorphism of chicken B-FI (major histocompatibility complex class I) molecules. Poult Sci [Internet]. 2004 Apr [cited 2016 Mar 2];83(4):600–5. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15109057
22. Livant EJ, Ewald SJ. High-resolution typing for chicken BF2 (MHC class I) alleles by automated sequencing. Anim Genet. 2005 Oct;36(5):432–4.
23. Hepkema BG, Hensen EJ, Blankert JJ, Zijpp AJ, Albers GAA, Tilanus MGJ, et al. Mapping of susceptibility to Marek’s disease within the major histocompatibility (B) complex by refined typing of White Leghorn chickens. Anim Genet [Internet]. 2009 Apr 24 [cited 2021 Mar 5];24(4):283–7. Available from: http://doi.wiley. com/10.1111/j.1365-2052.1993.tb00312.x
24. Juul-Madsen HR, Dalgaard TS, Guldbrandtsen B, Salomonsen J. A polymorphic major histocompatibility complex class II-like locus maps outside of both the chicken B-system and Rfp-Y-system. Eur J Immunogenet [Internet]. 2000 Apr [cited 2016 Mar 2];27(2):63–71.
25. Iglesias GM, Soria LA, Goto RM, Jar AM, Miquel MC, Lopez OJ, et al. Genotypic variability at the major histocompatibility complex (B and Rfp-Y) in Camperos broiler chickens. Anim Genet. 2003;34(2).
26. Goto RM, Afanassieff M, Ha J, Iglesias GM, Ewald SJ, Briles WE, et al. Single-strand conformation polymorphism (SSCP) assays for major histocompatibility complex B genotyping in chickens. Poult Sci. 2002;81:1832–41.
27. Fulton JE, McCarron AM, Lund AR, Pinegar KN, Wolc A, Chazara O, et al. A high-density SNP panel reveals extensive diversity, frequent recombination and multiple recombination hotspots within the chicken major histocompatibility complex B region between BG2 and CD1A1. Genet Sel Evol [Internet]. 2016;48(1):1. Available from: http://www.gsejournal.org/content/48/1/1
28. Lima-Rosa CA V, Canal CW, Streck AF, Freitas LB, Delgado-Cañedo A, Bonatto SL, et al. B-F DNA sequence variability in Brazilian (blue-egg Caipira) chickens. Anim Genet. 2004;35(4):278–84.
29. Goto R, Miyada CG, Young S, Wallace RB, Abplanalp H, Bloom SE, et al. Isolation of a cDNA clone from the B-G subregion of the chicken histocompatibility (B) complex. Immunogenetics [Internet]. 1988 Jan [cited 2016 Mar 3];27(2):102–9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2826332
30. Uni Z, Sklan D, Haklay N, Yonash N, Heller D. Response of three class-IV major histocompatability complex haplotypes to Eimeria acervulina in meat-type chickens. Br Poult Sci. 1995 Sep 1;36(4):555–61.
31. Iglesias GM, Huguet MJ, Goto RM, Miquel MC, Miller MM. Report of new alleles at BG loci in Camperos chickens. BAG - J Basic Appl Genet [Internet]. 2007 [cited 2016 Mar 2];18(1):29–30. Available from: http://www.scielo.org.ar/scielo.php?script=sci_arttext& pid=S1852-62332007000100006&lng=es&nrm=iso&tlng=en
32. Worley K, Gillingham M, Jensen P, Kennedy LJ, Pizzari T, Kaufman J, et al. Single locus typing of MHC class I and class II B loci in a population of red jungle fowl. Immunogenetics. 2008;60(5):233–47.
33. Chazara O, Chang C, Bruneau N. Diversity and evolution of the highly polymorphic tandem repeat LEI0258 in the chicken MHC - B region. 2013;447–59.
34. Nguyen-phuc H, Fulton JE, Berres ME. Genetic variation of major histocompatibility complex ( MHC ) in wild Red Junglefowl ( Gallus gallus ). 2012;400–11.
35. Han B, Lian L, Qu L, Zheng J, Yang N. Abundant polymorphisms at the microsatellite locus LEI0258 in indigenous chickens. Poult Sci [Internet]. 2013 Dec 1 [cited 2016 Mar 3];92(12):3113–9. Available from: http://ps.oxfordjournals.org/content/ 92/12/3113.full
36. Nikbakht G, Esmailnejad A, Barjesteh N. LEI0258 microsatellite variability in Khorasan, Marandi, and Arian chickens. Biochem Genet. 2013 Jun;51(5–6):341–9.
37. Manjula P, Park HB, Seo D, Choi N, Jin S, Ahn SJ, et al. Estimation of heritability and genetic correlation of body weight gain and growth curve parameters in Korean native chicken. Asian-Australasian J Anim Sci. 2018 Jan 1;31(1):26–31.
38. Iglesias GM, Canet ZE, Cantaro H, Miquel MC, Melo JE, Miller MM, et al. Mhc-B haplotypes in “Campero-Inta” chicken synthetic line. Poult Sci. 2019 Nov 1;98(11):5281–6.
39. Iglesias GM, Beker MP, Remolins JS, Canet ZE, Librera J, Cantaro H, et al. MHC-B variation in maternal and paternal synthetic lines of the Argentinian Campero INTA chicken. Poult Sci. 2021 Aug 1;100(8):101253.
40. Chazara O, Minvielle F, Roux D, Bed’hom B, Feve K, Coville JL, et al. Evidence for introgressive hybridization of wild common quail (Coturnix coturnix) by domesticated Japanese quail (Coturnix japonica) in France. Conserv Genet. 2010;11(3):1051–62.
41. Nguyen-Phuc H, Fulton JE, Berres ME. Genetic variation of major histocompatibility complex (MHC) in wild Red Junglefowl (Gallus gallus). Poult Sci. 2016 Feb 25;95(2):400–11.
42. Fulton JE, Berres ME, Kantanen J, Honkatukia M. MHC-B variability within the Finnish Landrace chicken conservation program. Poult Sci. 2017;96(9):3026–30.
43. Tarrant KJ, Lopez R, Loper M, Fulton JE. Assessing MHC-B diversity in Silkie chickens. Poult Sci. 2020 May 1;99(5):2337–41.
44. Wang H, Ma T, Chang G, Wan F, Liu X, Liu L, et al. Molecular Genotype Identification of Different Chickens: Major Histocompatibility Complex. Open Access J Sci Technol [Internet]. 2014 Sep 27 [cited 2016 Mar 3];2:1–7. Available from: http://www.agialpress. com/journals/oajost/2014/101111/
45. Lwelamira J, Kifaro GC, Gwakisa PS, Msoffe PLM. Association of LEI0258 microsatellite alleles with antibody response against newcastle disease virus vaccine and body weight in two Tanzania chicken ecotypes. African J Biotechnol. 2008;7(6):714–20.
46. Hunt HD, Jadhao S, Swayne DE. Major histocompatibility complex and background genes in chickens influence susceptibility to high pathogenicity avian influenza virus. In: Avian Diseases [Internet]. Avian Dis; 2010 [cited 2020 Aug 18]. p. 572–5. Available from: https://pubmed.ncbi.nlm.nih.gov/20521696/
47. Boonyanuwat K, Thummabutra S, Sookmanee N, Vatchavalkhu V, Siripholvat V. Influences of major histocompatibility complex class I haplotypes on avian influenza virus disease traits in Thai indigenous chickens. Anim Sci J. 2006;77(3):285–9.
48. Miller MM, Taylor RL. Brief review of the chicken Major Histocompatibility Complex: The genes, their distribution on chromosome 16, and their contributions to disease resistance. Poult Sci. 2016 Feb 25;95(2):375–92.
49. Dunnington EA, Briles WE, Briles RW, Siegel PB. Immunoresponsiveness in Chickens: Association of Antibody Production and the B System of the Major Histocompatibility Complex. Poult Sci. 1996;75(10):1156–60.
50. Gao Liu GF, Liu J, Zhou X, Kaufman J, Xia C, Zhang J, et al. Disease Susceptibility of B4 Chickens Peptide Transporter Restriction Can Explain MHC Class I Molecule BF2*0401 Plus Narrow Groove and Restricted Anchors of. J Immunol Ref [Internet]. 2020 [cited 2020 Jul 1];189:4478–87. Available from: http://www.jimmunol. org/content/189/9/4478http://www.jimmunol.org/content/189/9/4478. full#ref-list-1
51. Livant EJ, Ewald SJ. High-resolution typing for chicken BF2 (MHC class I) alleles by automated sequencing. Anim Genet. 2005;36(5):432–4.
52. Ewald SJ, Ye X, Avendano S, McLeod S, Lamont SJ, Dekkers JCM. Associations of BF2 alleles with antibody titres and production traits in commercial pure line broiler chickens. Anim Genet. 2007 Apr;38(2):174–6.
53. Haunshi S, Devara D, Ramasamy K, Ullengala R, Chatterjee RN. Genetic diversity at major histocompatibility complex and its effect on production and immune traits in indigenous chicken breeds of India. Arch Anim Breed. 2020;63:173–82.
54. Genious 5.6 [Internet]. Available from: http://www.geneious.com/
Fecha de recepción del artículo: 10/02/22
Fecha de aceptación para su publicación: 06/06/22