DOI: http://dx.doi.org/10.19137/cienvet-201921206
![]() Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No
Comercial-Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
Esta obra se publica bajo licencia Creative Commons 4.0 Internacional. (Atribución-No
Comercial-Compartir Igual) a menos que se indique lo contrario, http://www.creativecommons.org.ar/licencias.html
ARTÍCULO DE INVESTIGACIÓN
Posible leptospirosis clínica en dos gatos (Felis silvestris catus) del sur de la provincia de Santa Fe
Possible clinical leptospirosis in two cats (Felis silvestris catus) from the south of the Santa Fe province
Yaafar, NE.1; Prado A.5; Favot, NA. 2; Poli, GL.3; Sarradell, JE.4; Anthony, LM.4; Francois, SE.3
1 Cátedra de Clínica de Animales de Compañía.
2 Cát. de Química Biológica.
3 Laboratorio de leptospirosis de la Cátedra de Microbiología.
4 Cátedra de Patología General Veterinaria.
5 Cátedra de Histología I y Embriología Básica. Facultad de Ciencias Veterinarias de la
Universidad Nacional de Rosario, Ruta 33 y Bv. Spangemberg s/n (2179) Casilda, Santa Fe
Correo electrónico: veterinariayaafar@gmail.com
RESUMEN: La leptospirosis es una enfermedad infecciosa causada por Leptospira spp.. No suele considerarse como parte del diagnóstico diferencial en los gatos enfermos, lo cual reviste un riesgo significativo en la salud pública. Se describen dos posibles casos de leptospirosis clínica en gatos. Una hembra de 13 años y un macho de 7 años, ambos castrados, europeos de pelo corto, de dos localidades del sur de la provincia de Santa Fe. De hábitos indoor/outdoor, cazadores, convivientes con otros animales. Ambos ingresaron a la consulta por enflaquecimiento progresivo, anorexia y hematuria. Se solicitaron análisis de sangre para obtener hemograma completo, bioquímica sanguínea y determinaciones serológicas para detectar infecciones por Leptospira spp., los virus de la inmunodeficiencia felina (VIF) y leucemia felina (ViLeF). Los resultados del hemograma, el perfil hepático y renal, sumados a la sintomatología fundamentaron la sospecha de una presunta leptospirosis. Se detectaron anticuerpos contra Leptospira spp. en ambos felinos y en el macho también para VIF. Mediante la técnica de aglutinación microscópica (MAT), en la hembra se observaron los siguientes serovares y títulos de anticuerpos: Pomona 1:100, Icterohemorragiae: 1:200, Canicola: 1:200 y Grippothyphosa 1:100 y en el macho: Pomona 1:6400, Icterohaemorrhagiae 1:400 y Bratislava 1:50. Se instauró terapia antibacteriana en la hembra con bencilpenicilina benzatínica y procaínica más streptomicina 10000 UI/l/kg por vía subcutánea, cada 24 hs por 20 días, que posteriormente, se continuó con doxiciclina 10mg/kg oral por 30 días con el agregado de un complejo vitamínico. En el macho se empleó ampicilina sulbactam 20 mg/ kg cada 12 horas, por vía endovenosa. En ambos casos la evolución fue favorable, confirmando la eficacia clínica de los antibióticos betalactámicos en el tratamiento de la enfermedad. La hembra se recuperó. En el macho se interrumpió la quimioterapia antibacteriana y murió.
Palabras clave: Leptospirosis; Gatos; Aglutinación microscópica
ABSTRACT: Leptospirosis is an infectious disease caused by Leptospira spp.. It is not usually considered as part of the differential diagnosis in sick cats, which is a significant risk in public health. Two cases of clinical leptospirosis in cats confirmed by serology are described. They are both European mixed breed, a 13-year-old female and a 7-year-old male, castrated and from two towns in the south of Santa Fe province. They are hunters with indoor/outdoor habits, and live with other animals. They were admitted into the clinic due to progressive weight loss, anorexia and hematuria. Blood tests were taken to obtain complete blood count, blood biochemistry and serological determinations were performed to detect Leptospira spp, feline immunodeficiency virus (FIV) and feline leukemia (FeLV). The results of the hemogram, the hepatic and renal profile together with the symptomatology, comfirmed the suspicion of an alleged leptospirosis. Antibodies against Leptospira spp were detected in both cats and, in the male for FIV as well. Using the microscopic agglutination technique (MAT), the following serovars and antibody titles were detected in the female: Pomona 1: 100, Icterohemorragiae: 1: 200, Canicola: 1: 200 and Grippothyphosa 1: 100 and in the male: Pomona 1: 6400, Icterohaemorrhagiae 1: 400 and Bratislava 1:50. A treatment with benzathinic and procaine benzylpenicillin and streptomycin 10000 IU/l/kg subcutaneously was applied every 24 hours for 20 days as an antibacterial therapy. Subsequently, oral 10 mg/kg doxycycline was used for 30 days with the addition of a vitamin complex. In the male, ampicillin sulbactam 20 mg/kg was administered intravenously every 12 hours. In both cases the evolution was favorable, confirming the clinical efficiency of beta-lactam antibiotics for the disease treatment. The female recovered. In the male, antibacterial chemotherapy was interrupted and died.
Keywords: Leptospirosis; Cats; Microscopic agglutination
La leptospirosis es una enfermedad infecciosa contagiosa causada
por espiroquetas patógenas del género Leptospira(1). Es la zoonosis
más difundida a nivel mundial, en Argentina reviste carácter endémico(
2). Existe una clasificación serológica, L. interrogans sensu lato, que
incluye más de 250 serovares agrupados dentro de serogrupos, que
infectan a los animales y humanos(3). Los reservorios involucrados en
la transmisión comprenden una diversidad de animales domésticos,
como los cerdos, caballos, vacas, cabras, ovejas, perros y silvestres
dentro de los que se destacan los roedores. Los gatos pueden ser hospedadores
accidentales de varios serovares que prevalecen en dichos
reservorios(4). En cuanto a la transmisión ha sido sugerido que adquieren
la infección principalmente durante el acto de cazar roedores infectados,
más que por entrar en contacto con agua contaminada, por
su natural aversión a la misma(5,6,1). Los animales sufren una colonización
de los túbulos renales por las leptospiras que, posteriormente,
son excretadas en la orina durante períodos variables(4,7,6) El rol de
los felinos domésticos (Felis silvestris catus) en la epidemiología de la
leptospirosis ha recibido poca atención. Aunque existe evidencia serológica
de exposición, la enfermedad clínica en estos animales es reportada
muy raramente y se conoce muy poco acerca de su significancia
en esta especie(5,8). Se han observado casos clínicos en los que se ha
comprobado que las leptospiras patógenas causan daño a nivel renal.
(9,8,10)Los gatos infectados con Leptospira spp., pueden eliminar las espiroquetas
en la orina de forma intermitente durante varias semanas, aún sin demostrar signos clínicos de la enfermedad, constituyendo
una fuente potencial de transmisión al medio ambiente.(6,10,1) El hecho
de no considerarla en la lista de diagnósticos diferenciales en la clínica
de los gatos, reviste un riesgo significativo en la salud pública, para el
veterinario, los propietarios del animal y su entorno.(9,6,10)
En cuanto al diagnóstico de laboratorio, el aislamiento del microorganismo
es importante para confirmar el diagnóstico y a los fines
epidemiológicos, pero debido al tiempo de generación lento de las
leptospiras no resulta útil para diagnosticar la enfermedad. Por esta
razón el diagnóstico inmunológico mediante pruebas serológicas se
presenta como una opción rápida y factible. La técnica de referencia
estandarizada a nivel internacional para el diagnóstico serológico de
la enfermedad es la Técnica de Aglutinación Microscópica (MAT), que
es serovar específica y utiliza leptospiras vivas de diferentes serovares
como antígenos. La positividad en esta prueba no implica necesariamente
que el animal esté enfermo, sólo puede estar infectado.(7,6,3)Conjuntamente con la MAT pueden emplearse técnicas género específicas,
como la del TR. En ésta, se emplea el antígeno TR que es una
fracción termorresistente común al género Leptospira que reacciona
frente a cualquier serovar, pero un resultado positivo debe confirmarse
con la prueba de referencia.(3)
En agosto de 2016, en un Consultorio Veterinario de Fuentes (Departamento San Lorenzo, Santa Fe) ingresó a la consulta una hembra mestiza, castrada de 13 años, de nombre Gorda, que convivía con dos perros y tres gatos. Sus hábitos eran outdoor, pasaba gran parte del día en el exterior de la vivienda familiar, compartiendo el lugar con perros callejeros. La alimentación que recibía estaba basada en alimento balanceado con el agregado de alimento casero. Los caninos convivientes habían sido vacunados de forma anual con vacuna séxtuple más antileptospira y antirrábica y los gatos sólo habían recibido vacunas antirrábicas. El motivo de la consulta fue el enflaquecimiento progresivo, anorexia y hematuria. Al examen clínico se observó un peso de 3.20 kg., una leve disnea y lagañas mucosanguinolentas. Durante la palpación renal se detectó dolor. Se instauró un tratamiento de sostén con analgésicos (tramadol 1 mg/kg cada 12 hs) y complejo vitamínico/ mineral oral (cada 12 h). Como diagnóstico presuntivo se sospechó de insuficiencia renal y se incluyó a la leptospirosis dentro del diagnóstico diferencial. Se solicitaron análisis de sangre para observar la bioquímica sanguínea, serología para leptospirosis y ecografía de la cavidad abdominal. No fue posible realizar serología para descartar las infecciones con los virus de la inmunodeficiencia felina (VIF) y de la leucemia felina (ViLeF). Tampoco se realizó la ecografía abdominal por lo que no se pudo observar el estado del hígado y los riñones. Los análisis de sangre arrojaron los siguientes resultados: hematocrito 32%, sólidos totales 7.2 g/dl, hemoglobina 8 g/dl, recuento de glóbulos rojos 7.04 x 106 /mm3, VCM 45fL, CHCM 28%, leucocitos 7100 x mm3. Neutrófilos segmentados 69%, neutrófilos en banda 1%, linfocitos 15 %, eosinófilos 10%, monocitos 5 % y plaquetas aglomeradas. No se observó presencia de hemoparásitos. Urea: 33 mg/dl, creatinemia: 1.36 mg/dl; ALT (GTP): 11 UI/l; AST (GOT): 45 UI/l; ALP (FAS): 77 UI/l. Los análisis serológicos para el diagnóstico de la leptospirosis se hicieron mediante dos técnicas serológicas, una género específica de aglutinación macroscópica con antígeno termorresistente (TR) y la de referencia, que es el test de aglutinación microscópica (MAT) que es serovarespecífica3. Mediante la técnica del TR se obtuvo un resultado positivo fuerte y mediante la MAT se detectaron los siguientes serovares y títulos de anticuerpos: Pomona 1:100, Icterohemorragiae: 1:200, Canicola: 1:200 y Grippothyphosa: 1:100. Tras la sospecha de una posible leptospirosisse procedió a instaurar un tratamiento con bencilpenicilina benzatínica y procaínica y estreptomicina 10000 UI/l/kg SC cada 24 hs por 20 días que posteriormente a ese período se continuó con doxiciclina 10mg/kg oral por 30 días con el agregado de un complejo vitamínico. La paciente, al día siguiente mejoró su ánimo y comenzó a comer. En ese momento no fue posible realizar un nuevo análisis serológico para observar seroconversión. La gata evolucionó favorablemente y remitieron los signos. Se realizó un chequeo serológico para determinar infección leptospirósica a los caninos y felinos que compartían la vivienda, el cual resultó negativo. Se revacunaron los caninos contra leptospirosis. En octubre del 2017, la gata volvió a consulta con los mismos síntomas del año anterior. Se le solicitaron nuevos análisis, serología y ecografía, pero solamente accedió a repetir la serología para leptospirosis. En esta oportunidad se observó un resultado similar con la prueba del TR y con la MAT los siguientes hallazgos: Pomona: 1:100, Icterohemorragiae: 1:50, Canicola: 1:200 y Grippothyphosa: 1:100. Tampoco se logró realizar un segundo sangrado para observar seroconversión en esta ocasión. Se repitió el tratamiento original por el mismo lapso de tiempo y se notó una mejoría en la salud del animal. La gata sobrevivió pero no volvió a la consulta.
En marzo de 2019, se recibió en una Clínica Veterinaria de la zona oeste de Rosario, un gato doméstico, macho, castrado, de 7 años, común europeo, de pelo corto, llamado Tigre (Figura Nº 1).

De hábitos doméstico, callejero y cazador, que convivía con dos gatos y un perro. La alimentación era en parte alimento casero y se complementaba con alimento balanceado. Ninguno de los animales de la casa había recibido vacunas contra Leptospira. Tigre, cazaba roedores, tanto fuera como dentro de su vivienda, ubicada en la zona oeste de Rosario. El motivo de consulta fue decaimiento y anorexia. Al examen clínico presentó hipotermia, T 32.6 °C, bradicardia, disnea, abundante moco amarillo verdoso en nariz, tiempo de llenado capilar (TLLC) enlentecido, deshidratación severa, polidipsia, hematuria leve. Además se observó necrosis en la punta y costados de la lengua (Figura Nº 2).

Presentó un peso de 4.2 kg, el que se consideró bajo, teniendo en
cuenta que se trataba de un gato de gran tamaño. Se establece como
diagnóstico presuntivo enfermedad renal.
Se instauró tratamiento con fluidoterapia endovenosa (EV) con
ringer lactato, ampicilina sulbactam 20 mg/kg cada 12 horas, por vía
endovenosa (EV), ácido tióctico 5 mg/kg cada 24 hs EV, ranitidina 1
mg/Kg cada 12 horas vía subcutánea (SC), tramadol 2 mg/Kg cada 12
horas, sucralfato, 2 ml por vía oral cada 12 hs (VO), suplemento de
vitaminas y aminoácidos. Se planificó internación diurna, regresando
a su domicilio por la noche. El primer día se retiró con T 36.8°C,
los demás signos y síntomas sin cambios significativos. Los análisis
de sangre realizados revelaron: hematocrito: 27%, sólidos totales 8.3
g/dl, hemoglobina 9 (g/dl), eritrocitos (cantidad/mm3): 3.857.142,
leucocitos (cantidad /mm3): 19850, plaquetas (número / campo):
162000. Neutrófilos segmentados (%): 87, neutrófilos en banda (%):
8, linfocitos (%): 4, monocitos (%): 1. Hipoproteinemia e hipoalbuminemia.
La urea fue de 661 mg/dl (valores normales 20-50 mg/dl) y la
Creatinina de 4.5 mg/dl (1.5 mg/dl). Glicemia 86 mg/dl. Los valores
hallados para las enzimas hepáticas fueron: GOT: 77 UI/L (hasta 50
UI/L), GPT 29 UI/L (hasta 60 UI/L), FAS 25 UI/L (hasta 100 UI/L).
Debido a la sintomatología clínica y a los resultados de los análisis, se
incluyó a la leptospirosis como diagnóstico diferencial.
Al día siguiente el paciente ingresó con un TLLC enlentecido y
mucosas pálidas. Se continuó con el tratamiento instaurado, y se incorporó citrato de maropitant 0.5 mg/Kg cada 24 horas. Comenzó a beber agua, se retiró con T. 36.5°C y estado del sensorio más alerta.
Se sugirió a los propietarios ofrecerle comida, agua y controlar las
excretas. Además se recomendó no bañar para no estresar al animal.
Al día siguiente llegó a la clínica con una T. 37°C, TLLC 2 segundos,
mucosas rosa pálido, pero más alerta que el día anterior. Continuaba
con hematuria leve, se estimó una deshidratación del 5% por lo que
se administró fluido terapia de 200 ml/día, constituida por el 50%
de solución ringer lactato y 50% de dextrosa al 5%. Como el paciente
continuó inapetente se administró mirtazapina 1.88 mg totales, lo que
se suspendió posteriormente por la presentación de náuseas. Se instiló solución fisiológica en nariz, para despejar las vías aéreas superiores.
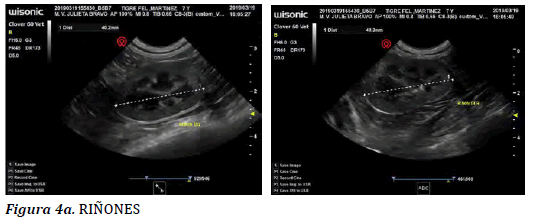
La ecografía de la región abdominal permitió observar: hígado de
forma y tamaño conservados con contornos netos, ángulos aguzados,
superficie lisa y regular, con ecogenicidad disminuida, lesiones focales,
con circulación intrahepática conservada y vías biliares sin dilatación.
Conclusión hígado con patrón reactivo/inflamatorio y escaso
barro biliar (Figura Nº4c). Páncreas con ecogenicidad conservada,
ecoestructura granular conservada. Tracto gastrointestinal y bazo sin
particularidades. Riñones de forma, tamaño y contornos conservados
con cortezas adelgazadas y aumento de la ecogenicidad. La diferenciación
cortico-medular fue conservada. Pelvis ventrículos sin dilatación.
Seno renal de ecogenicidad conservada (Figura Nº 4a). Vejiga distendida
con contenido líquido con ecos en suspensión que decantan, alitiásica.
Con presencia a nivel de la cara endoluminal craneal, de un
engrosamiento nodular que se proyecta hacia el interior de la luz, hipoecoico,
de 3.8 x 5 mm de diámetro (Fig. 4 b). Linfonódulos conservados.
Conclusión: nefropatía difusa, sedimento urinario de tipo mixto,
lesión focal vesical. Se realizaron análisis serológicos para la detección
del Virus de la inmunodeficiencia felina (VIF), el Virus de la leucemia
felina (ViLeF) y leptospirosis. Los cuales dieron resultados positivos
para VIF y Leptospira spp. En este último caso, en un primer análisis,
se observó un título de anticuerpos de 1:6400 para L. interrogans Pomona, 1:400 para Icterohaemorrhagiae y 1:50 para Bratislava. Una
semana después, se analizó una segunda muestra, para observar seroconversión,
mediante el test de aglutinación microscópica (MAT). No
se hallaron diferencias en los títulos a Pomona e Icterohaemorrhagiae
y desapareció la reactividad a Bratislava. Se comenzó a observar al
paciente más animado, normotérmico, mucosas levemente rosadas,
pero presentando polidipsia y poliuria, aunque, en esa instancia no se
observó hematuria. Se continuó con el mismo tratamiento y alimentación
forzada. Al día siguiente, Tigre mostró otra actitud, maulló y presentó mayor resistencia a la manipulación durante la revisación.
No se constató deshidratación y demostró aumento del apetito. Al tratamiento
se agregó omega 3 en forma oral. Se observaron cambios notorios
en la lengua (Figura Nº 3) y la temperatura corporal ascendió a
38°C. Se realizó un nuevo chequeo sanguíneo y se pudo observar que
el paciente había evolucionado favorablemente, por lo que se instauró un tratamiento ambulatorio. Los propietarios declararon que al ver el
cambio en la salud del gato, le permitieron salir, con lo cual se ausentó de la vivienda por 3 días. Cuando decidieron traerlo nuevamente, el
paciente ingresó al consultorio con decaimiento y deshidratación moderada.
Como no fue posible que asistiera diariamente, se le administró doxiciclina por vía oral, 5 mg/Kg cada 12 horas con bolos de agua
para evitar la presentación de esofagitis. En los últimos días de marzo,
Tigre presentó distrés respiratorio, hiporexia y bebía poca agua. El paciente
siguió decaído, con dificultad respiratoria, TLLC mayor a 2 segundos
y mucosas muy pálidas. El 29 de marzo, el cuadro empeoró, el
decaimiento fue mayor, la temperatura corporal disminuyó y presentó nauseas. Se le realizó punción de tórax que fue positiva en ambos hemitórax,
con colecta serohemática. Se aplicó furosemida 2 mg/kg cada
6 horas EV pero Tigre murió 24 h después.
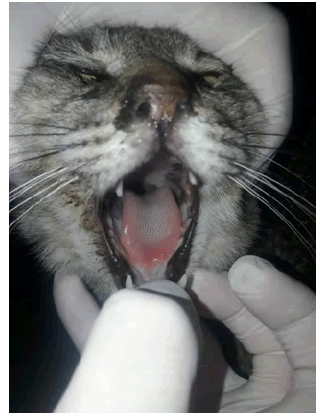
Figura 3. Cambios favorables de las lesiones linguales luego de 5 días de tratamiento.
Se realizó la necropsia, observándose efusión pleural y abdominal,
se extrajeron órganos tales como: riñones, hígado, bazo y pulmones,
los cuales se colocaron parte en formol al 10% para estudios histopatológicos
y otros se remitieron refrigerados en forma inmediata al
laboratorio de leptospirosis de la Facultad de Ciencias Veterinarias,
UNR, para estudios bacteriológicos. Se realizó cultivo de los órganos
como así también, de orina extraída asépticamente mediante compresión
vesical, en medios especiales para Leptospira, como Fletcher
y EMJH, los cuales fueron incubados a 30°C durante varias semanas,
pero no se obtuvo desarrollo. Tampoco se observaron elementos compatibles
con Leptospira spp. en el exámen directo de las muestras mediante
microscopía de campo oscuro con aumentos de 400X.
Los estudios histopatológicos indicaron que en riñón se pudo observar
nefritis intersticial multifocal leve caracterizada por una escasa
presencia de agregados de células mononucleares linfoides a nivel intersticial.
En el hígado se observó, hepatitis intersticial leve con presencia
de pigmentos biliares visibles en espacios compatibles con canalículos
biliares, proceso degenerativo microvacuolar de moderada
intensidad, con marginación de neutrófilos sinusoidales e hiperplasia
de células de Kupffer, muerte de hepatocitos individuales y presencia
de un moderado número de hepatocitos binucleados. El resto de losórganos no presentó lesiones aparentes.

La información disponible sobre la leptospirosis en los gatos es escasa
si se compara con la referente a la leptospirosis canina(9). Los reportes
existentes indican que la enfermedad clínica en el gato es rara
y que los adultos, de cualquier raza o sexo son los más afectados.(9,4,5,11) Lo que quizás esté relacionado con el hábito de cazar presas contaminadas,
que se da con mayor frecuencia en la adultez. Por lo tanto,
el hecho de cazar y principalmente hacerlo lejos del domicilio, pone a
los gatos callejeros en situaciones de riesgo de contraer leptospirosis.
Otro factor de riesgo importante en estos casos, es la posibilidad de
que los gatos tomen contacto con la orina de animales infectados, tales
como caninos, equinos, aves y otros posibles reservorios que circulen
en la misma zona(9). Los casos descriptos se trataron de gatos adultos,
cazadores, con hábitos de callejeo en áreas urbanas y suburbanas.
Uno ocurrió durante el otoño, que es cuando aumenta la frecuencia de
aparición de casos de leptospirosis por ser la estación asociada con lluvias y temperaturas estables, condiciones que favorecen la sobrevida
de las leptospiras en el medioambiente. Es conocida la influencia
de la estación lluviosa en la producción de la enfermedad, la cual se ha
podido observar para los caninos. (12) El otro, ocurrió durante el invierno,
hecho que también ha sido reportado por investigadores en otras
partes del mundo.(9)
Los artículos publicados sobre leptospirosis clínica en gatos refieren
que la mayoría demostró algún grado de insuficiencia renal con
valores incrementados de urea y creatinina y en algunos casos se observó hematuria. (9,11) En estos dos casos, también se observó hematuria
y aumentos en la concentración sanguínea de dichos parámetros,
así como las consecuencias de tales incrementos. En la cavidad bucal
del gato, se observaron úlceras y necrosis de lengua que quizás fueron
manifestaciones del daño ocasionado en las mucosas por la alta concentración
de amoníaco en la saliva generada por la uremia. Estas lesiones
resultaron similares a las observadas en caninos seropositivos
a Leptospira spp. (13,14) En tanto, la hematuria pudo haber tenido su origen
en hemorragias provocadas por la acción de las toxinas con acción
de hemolisinas producidas por cepas virulentas de Leptospira spp.(13)
En cuanto a las enzimas hepáticas, solamente se observó un valor
por encima de lo normal en relación a la transaminasa glutámico
oxalacética (GOT), lo que concuerda con lo observado por otros autores
a nivel mundial.(9) En el caso 2, los hallazgos histopatológicos
realizados postmorten, demostraron signos de nefritis instersticial,
indicando el daño padecido a nivel renal. A nivel hepático, se registró principalmente una hepatitis intersticial y muerte de hepatocitos, que
pudo haberse producido por la acción citotóxica de la glicoproteína
de Leptospira, que ha sido descripta a este nivel.(2) En este gato, además
se evidenció una ictericia moderada, síntoma que es inconstante,
según lo relatado en la bibliografía. Por el contrario, la poliuria y polidipsia,
se relatan como signos clínicos observados desde el inicio de
las consultas en todos los casos descriptos de leptospirosis en gatos.
(9) Otro hallazgo concordante con los de autores en otros países, es la
detección serológica de un título de anticuerpos elevado a Pomona,
así como las coaglutinaciones entre serovares observadas en ambos
casos, que son indicios de una infección con Leptospira spp.(9,8,11)
L. interrogans Pomona es un serovar de alta virulencia, que en
Argentina está ampliamente diseminado y es causante de leptospirosis
en los animales domésticos.(11,3,2)A pesar del alto título de anticuerpos
encontrado para este serovar, no es posible atribuirle fehacientemente
la causa de la enfermedad porque no se logró su aislamiento. Tigre,
también resultó ser positivo para el virus de la inmunodeficiencia felina, lo cual pudo haberlo predispuesto a padecer la leptospirosis
En el caso 1, tampoco fue posible identificar el serovar causante, no
obstante, se obtuvo un diagnóstico presuntivo de leptospirosis mediante
el empleo de dos técnicas serológicas, una género específica y
otra serovar específica. El diagnóstico de la enfermedad en los gatos es
complicado debido a las presentaciones clínicas o subclínicas que puede
tener en esta especie. Por otro lado, las reacciones cruzadas entre
serovares y la ausencia de una respuesta inmune humoral adecuada
en el hospedador pueden ser una dificultad para interpretar adecuadamente
los resultados de la MAT(7).
El tratamiento instaurado inicialmente con antibacterianos derivados
de la penicilina y posteriormente con doxiciclina parece ser eficaz
para eliminar la infección y evitar el estado de portador renal, lo que
ha sido reportado también por otros autores.(7,11)
Las publicaciones existentes han demostrado que el gato ya no
debe considerarse como un animal refractario a la leptospirosis, pues
su susceptibilidad ha sido evidenciada en relatos de estudios epidemiológicos
y casos clínicos publicados en los últimos años.(11,10) Por lo
tanto, es importante que los profesionales Veterinarios puedan considerar
el diagnóstico de leptospirosis en gatos con alteraciones patológicas
renales y/o hepáticas, teniendo en cuenta que de acuerdo con la
bibliografía y lo que sugieren los casos expuestos, son los signos más
comúnmente presentados cuando surge la enfermedad clínica, principalmente,
en aquellos que cuenten con un historial de cazadores y
callejeros.
Bibliografía:
1. Schuller S, Francey T, Hartmann K, et al. European consensus statement on leptospirosis in dogs and cats. J of Small Animal Practice. 2015; 56:159–179.
2. Stanchi N, Martino P, Gentilini E, et al. Microbiología Veterinaria. Inter-Médica; 2007.
3. Picardeau M. Diagnosis and epidemiology of leptospirosis. MédMaladiesInfect. 2013;43: 1-9.
4. Azócar-Aedo L, Smiths HL, Monti G. Leptospirosis in dogs and cats: Epidemiology, clinical disease, zoonotic implications and prevention. ArchMedVet. 2014; 46: 337-348.
5. Markovich JE, Ross L, McCobb E. The prevalence of leptospiral antibodies in free roaming cats in Worcester County, Massachusetts. J VetInternMed. 2012; 26: 688-689.
6. Peixoto Ribeiro T, Dias Santos H, Pereira Sousa S, Rocha Galvão S, Silva Reis T, de Sá Jaime V. Infecção por Leptospiraspp. em Gatos (Felissilvestriscatus). Uma Revisão. Brazilian Journal of Hygiene and Animal Sanity.2018; 12 (1):101-119.
7. Hartmann K, Egberink H, Pennisi MG, et al. Leptospira Species Infection in Cats: ABCD guidelines on prevention and management. J of Feline Medicine and Surgery. 2013;15(7):576-81. doi :10.1177/1098612X13489217.
8. Larsson CE, Santa Rosa CA, Hagiwara MK, et al. Prevalence of feline leptospirosis: serologic survey and attempts of isolation and demonstration of the agent. Int J Zoonose 1984; 11 (2): 161-9.
9. Arbour J, Blais MC, Carioto L, Silvestre D. Clinical leptospirosis in threecats (2001-2009). J Am AnimHosp Assoc. 2012; Jul-Aug; 48 (4):256-60. doi:10.5326/ JAAHA-MS-5748.
10. Rodríguez J, Blais M C, Lapointe J, Arsenault L, Carioto L, Harel J. Serologic and urinary PCR survey of leptospirosis in healthy cats and in cats with kidney disease. J Vet Intern Med. 2014; 28:284-293.
11. Ojeda J, Salgado M, Encina C, Santamaría C, Monti G. Evidence of interspecies transmission of pathogenic Leptospira between livestock and a domestic cat dwelling in a 5 dairy cattle farm. J Vet Med Sci. 2018; 80(8):1305-1308.
12. Ward MP. Seasonality of canine leptospirosis in the United States and Canada and its association with rainfall. Prev. Vet. Med. 2002; 56 (3): 203-13.
13. Luna AM, Moles CL, Gavaldón RD, Nava VC, Salazar GF. La leptospirosis canina y su problemática en México. Rev. Salud Anim. 2008; 30 (1): 1-11.
14. Poli GL, Prado A, Guerra N y Francois SE. Casos clínicos de leptospirosis en perros. Drovet News. 2016: 21-23.
Fecha de recepción artículo original: 20-10-19
Fecha de aprobación para su publicación: 02-12-2019